为了探究铁和硫酸铜溶液反应中量的关系,某兴趣小组做了五组实验,实验结果记录如下:
| 编号 |
加入铁的质量/g |
硫酸铜溶液体积/mL |
生成铜的质量/g |
| 1 |
1.12 |
10.0 |
1.28 |
| 2 |
x |
10.0 |
2.56 |
| 3 |
3.36[ |
10.0 |
3.84 |
| 4 |
4.48 |
10.0 |
4.98 |
| 5 |
5.60 |
20.0 |
y |
则表格中记录的x和y的数值应分别为
A.2.24、4.98 B.2.24、6.40 C.3.36、5.12 D.3.36、4.98
某化学小组在课外活动时做了一个实验,在甲试管中装入固体物质,乙试管装入某溶液,按下图所示组装好仪器(图中铁架台等仪器已略去).通过分液漏斗加入足量稀盐酸,同时打开止水夹,看到乙试管溶液中有气泡冒出;再关闭止水夹,发现一段时间后乙中溶液变浑浊.符合此实验现象的一组试剂是
| 选项 |
A |
B |
C |
D |
| 甲中固体 |
KOH |
Na2CO3 |
Zn |
CaCO3 |
| 乙中溶液 |
BaCl2 |
NaOH |
AgNO3 |
Ca(OH)2 |
现有Fe、CuO、MgCl2、Ca(OH)2、稀H2SO4等五种物质,在常温下两两相互发生的化学反应有
| A.7个 | B.6个 | C.5个 | D.4个 |
根据事物的某些相似性类推其他的相似性,并预测类似的可能性,是我们经常使用的一种思维方法。以下类推结果与实际相符的是
①氧化物中都含有氧元素含有氧元素的化合物都是氧化物
②饱和溶液不能继续溶解某种溶质饱和溶液也不能继续溶解其他溶质
③氢氧化钠溶液中有OH一能与酸反应 氢氧化钾溶液中也有OH一也能与酸反应
④酸与碱作用生成盐和水的反应叫中和反应生成盐和水的反应都是中和反应
| A.①②④ | B.②③④ | C.只有③ | D.①②③④ |
下列有关溶液的说法不正确的是
| A.汽水和蔗糖水都属于溶液 |
| B.物质的溶解度不一定都随温度的升高而增大 |
| C.在一定条件下,饱和溶液与不饱和溶液之间可以相互转化 |
| D.某物质在100 g溶剂里达到饱和状态时所溶解的质量就是该物质的溶解度 |
“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是著名的“侯氏制碱法”的重要反应.下面是4位同学对该反应涉及的有关知识发表的部分见解.其中不正确的是
 |
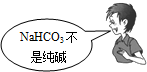 |
 |
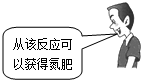 |
| A |
B |
C |
D |