在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知CO(g)+2H2(g) CH3OH(g) ΔH=-90.7 kJ/mol):
CH3OH(g) ΔH=-90.7 kJ/mol):
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1 mol CO、2 mol H2 |
1 mol CH3OH |
2 mol CH3OH |
| CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出a kJ |
吸收b kJ |
吸收c kJ |
| 平衡时压强(Pa) |
P1 |
P2 |
P3 |
| 反应物转化率 |
α1 |
α2 |
α3 |
下列说法不正确的是
A.c1=c3 B.a+c/2<90.7 C.2P2>P3 D.α1+α3=1
下列关于有机物的正确说法是( )
| A.等物质的量的CH4与Cl2恰好反应时,生成CH3Cl与HCl |
| B.煤干馏可得到大量汽油和煤油 |
| C.聚氯乙烯塑料最适合用来做蔬菜、水果及熟食等的保鲜膜 |
D.异丁烷(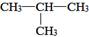 )与正丁烷互为同分异构体 )与正丁烷互为同分异构体 |
在一定条件下能发生水解反应的高分子化合物是( )
| A.肥皂 | B.油脂 | C.纤维素 | D.聚乙烯 |
下列化学用语表达正确的是( )
A.羟基的电子式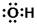 |
B.乙烯的结构简式是CH2CH2 |
| C.醛基的结构简式是—COH | D.淀粉的分子式是 (C6H10O5)n |
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述正确的是( )
| A.淀粉水解的最终产物是葡萄糖 |
| B.植物油不能使溴的四氯化碳溶液褪色 |
| C.葡萄糖能发生水解和氧化反应 |
| D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
下列说法不正确的是()
| A.物质发生化学反应的反应热仅指反应放出的热量 |
| B.所有的燃烧都是放热反应 |
| C.热化学方程式中各物质的化学计量数只表示物质的量,不表示分子的个数 |
| D.热化学方程式中化学式前面的化学计量数可以是分数 |