利用染化厂的废料铁泥(主要成分是Fe2O3、FeO和铁)制备可用于隐形飞机涂层的纳米四氧化三铁的生产流程为: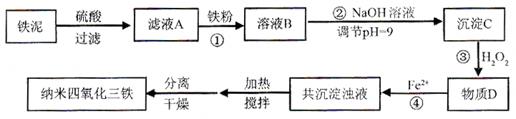
请回答:
(1)过程①主要反应的离子方程式为 。
(2)已知氢氧化亚铁的Ksp=4.87×10-17,氢氧化铁的Ksp=2.6×10-39。
当溶液中某离子浓度不高于1×10-5 mol·L-1时,可以认为该离子已经完全沉淀。通过计算所得数据说明过程②调节pH=9的原因是 。
(3)物质D的主要产物中铁、氢、氧三种元素的质量比为56∶1∶32,则过程③主要反应的化学方程式为 。
(4)已知Fe2+在弱碱性溶液中还原性较强,图11是研究过程④的实验所得,则该反应所需的时间控制在 小时左右,较为适宜。
(5)某工厂处理废铁泥(测得铁元素含量为16.8 %)的能力为10吨/小时,生产纳米四氧化三铁的产量为4.64吨/小时。如不考虑过程④以后生产中Fe2+的氧化,则该工厂每小时消耗铁粉的质量为 千克。
完成下列化学用语的书写:
(1)用离子方程式表示碳酸钠溶液显碱性的原因:___________________。
(2)实验室配制的CuSO4溶液,常常出现浑浊的原因是
(写离子方程式),可采取在配制时加入少量防止出现浑浊。
(3)泡沫灭火器中盛放的灭火剂包括Al2(SO4)3溶液(约1 mol/L)、NaHCO3溶液(约1 mol/L)及起泡剂。使用时发生反应的离子方程式是________________________________
(4)已知断裂1 mol H2(g)中的H—H键需要吸收436kJ的能量,断裂1 mol O2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中的1mol H—O键能放出463kJ的能量。试写出O2(g)与H2(g)反应生成H2O(g)的热化学方程式:。
下表列出了①~⑨九种元素在周期表中的位置。请回答(用化学用语):
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑤ |
⑥ |
||||||
| 3 |
① |
③ |
④ |
⑦ |
⑨ |
|||
| 4 |
② |
⑧ |
(1)在这些元素中,最活泼的金属元素是;最活泼非金属元素是;最不活泼的元素是。
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的化合物的分子式是;碱性最强的化合物的电子式;能形成两性氢氧化物的元素是。
(3)①、②、③三种元素的原子半径由大到小的顺序依次为。
(4)⑥元素的氢化物是 ,该氢化物在常温下与②发生反应的化学方程式为,所得溶液的PH7.
(5)用电子式表示 ①和⑧元素形成化合物的过程。
H2-O2/KOH 电池,负极反应式:正极反应式:
在Zn、Cu、稀硫酸组成的原电池中负极是.正极反应式:, 电池总反应式:__ ___(离子方程式),电流从_ __极到__极,溶液中H+ 移向 __极,电池工作一段时间后电解质溶液PH值会变_ _
将气体A、B置于容积为2L的密闭容器中,发生如下反应:3A(g) +B(g) 2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6 mol,C的物质的量为0.4 mol,则:①用C表示该反应的速率为:;
2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6 mol,C的物质的量为0.4 mol,则:①用C表示该反应的速率为:;
②用A表示的速率为:;
③反应前A的物质的量浓度是:;
④10s末,D的浓度为:;