1994年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图,呈V型,两个O----O键的夹角为116.5o。三个原子以一个O原子为中心,另外两个O原子分别构成一个共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键——三个O原子均等地享有这个电子。请回答: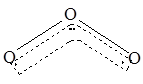
(1)臭氧与氧气的关系是_____________
(2)写出下列分子与O3分子的结构最相似的是_______________
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(3)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有 对孤对电子。
(4)O3分子是否为极性分子 (填是或否)。
(5)O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
PbS + O3 ==== PbSO4 + O2
生成1mol O2的转移电子物质的量为 mol。
(12分)
25℃时,三种酸的电离常数为:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数K |
1.8×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
3.0×10-8 |
请回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:________(填编号)
(2)常温下0.1 mol/L的CH3COOH在水中约有1%发生电离,其溶液的pH=________,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)D.c(OH-)/c(H+)
(3) 体积为10 mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000 mL,稀释过程pH变化如图;则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”)。
(4) 25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=_______mol/L(填准确数值)。
(4分)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol ·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++H2Y2-===CuY2-+2H+
(1)写出计算CuSO4·5H2O质量分数的表达式w=_______________;
(2)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是________。
A.未干燥锥形瓶 B.滴定终点时滴定管尖嘴中产生气泡
C.未除净可与EDTA反应的干扰离子
(10分)A~F六种元素中,除A外均为短周期元素,它们的原子结构或性质如下表所示:
| 元素 |
原子结构或性质 |
| A |
生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| B |
二价阳离子与Ne原子具有相同的电子层结构 |
| C |
形成化合物种类最多的元素,其单质为固体 |
| D |
地壳中含量最多的元素 |
| E |
与D同主族 |
| F |
与E同周期,且最外层电子数等于电子层数 |
(1)A的某种氯化物的浓溶液可用于制作印刷电路铜板,反应的离子方程式为:________________。
(2)CD2分子中化学键的类型是_______________;其与上述某元素形成的物质发生置换反应的化学方程式是______________________。
(3)F的最高价氧化物对应的水化物与E的最高价氧化物对应的水化物反应的离子方程式为_______。
(4)由B、D两种元素形成的化合物的电子式为。
(8分)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)  2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)如图中表示NO2变化曲线的是 。用O2表示从0 s~2 内该反应的平均速率v= mol/(L·s)。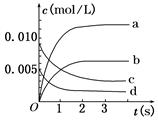
(2)能说明该反应已达到平衡状态的是 .
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
某化学反应的反应物和产物如下:Al+NaNO3+H2O→Al(OH)3+N2+NaAlO2
(1)该反应的氧化剂是_____________。
(2)该反应的氧化产物是______________。
(3)反应过程中转移5 mol e-,生成标准状况下N2的体积__________ L。
(4)配平该反应的化学方程式:___Al+____NaNO3+___H2O=______Al(OH)3+____N2+___NaAlO2。