新型高能钠硫电池以熔融的钠、硫为电极,以钠离子导电的陶瓷为固体电解质。该电池放电时为原电池,充电时为电解池。反应原理为:2Na+ xS = Na2Sx。
请回答下列问题:
(1)放电时S发生________反应,Na为______极。
(2)充电时Na所在电极与直流电源________极相连。
(3)充电时阳极反应为_________________;放电时负极反应为_______________。
(4)用此电池电解饱和NaCl溶液,当阳极产生11.2 L(标准状况下)气体时,消耗金属钠_____g。
有机化合物A的相对分子质量大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
⑴该化合物分子中含有个氧原子。
⑵该化合物的摩尔质量是。
⑶化合物化学式为。
含苯酚的工业废水处理的流程图如下图: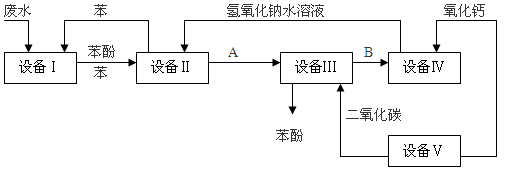
(1)上述流程里,设备Ⅰ中进行的是______操作(填写操作名称)。实验室里这一步操作可以用______进行(填写仪器名称)。
(2)由设备Ⅱ进入设备Ⅲ的物质A是______,由设备Ⅲ进入设备Ⅳ的物质B是______。
(3)在设备Ⅲ中发生反应的化学方程式为:______________________________________。(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过______操作(填写操作名称),可以使产物相互分离。
(5)上图中,能循环使用的物质是C6H6、CaO、______、______。
已知(1) (R和R’代表烃基)
(R和R’代表烃基)
(2)苯的同系物能被高锰酸钾氧化,如:
(3)
(苯胺,弱碱性,易氧化)
化合物C是制取消炎灵(盐酸祛炎痛)的中间产物,其合成路线为:
请回答下列问题:
(1)写出反应④的主要产物中含有官能团(除苯环外)的结构简式_____________。
(2)B物质的结构简式是_____________。
(3)反应①②的化学方程式
①_______________________________________,
②_______________________________________。
(4)反应①~⑤中,属于取代反应的是(填反应序号)_____________。
化合物A(C8H17Br)经NaOH醇溶液处理后生成两种烯烃B1和B2。B2(C8H16)经过1.用臭氧处理,2.在Zn存在下水解,只生成一种化合物C。C经催化氢化吸收一摩尔氢气生成醇DC4H10O.,用浓硫酸处理D只生成一种无侧链的烯烃E(C4H8.)。已知: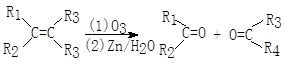
注:R1、R3可为H或其它烃基
试根据已知信息写出下列物质的结构简式:
A______________________B2_______________
C_____________________ E________________
A是烃的衍生物,加热时在NaOH溶液中水解,并能发生下列转变关系:
若A、B、C、E均能发生银镜反应,试写出它们的名称:
A:___________;B:__________;C:___________;D:___________;E:___________。