下列离子方程式正确的是()
| A.澄清石灰水与稀盐酸反应 Ca(OH)2 + 2H+=Ca2+ + 2H20 |
| B.碳酸钠溶液与盐酸反应 Na2CO3 + 2H+=2Na+ + H2O + CO2↑ |
| C.稀硫酸与氢氧化钡溶液反应 H+ + OH- +Ba2+ +SO42-=H2O+ BaSO4↓ |
| D.氢氧化铜与稀硫酸反应 Cu(OH)2 + 2H+= Cu2+ +2H2O |
对于可逆反应:2A(g)+B(g) 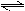 2C(g);△H<0,下列各图中正确的是
2C(g);△H<0,下列各图中正确的是
在密闭容器中进行如下反应:X2(g)+Y2(g) 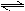 2Z(g),已知X2(g) 、Y2(g)、Z(g)的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2(g) 、Y2(g)、Z(g)的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
| A.X2为0.2 mol/L | B.Z为 0.3 mol/L | C.Y2为 0.4 mol/L | D.Z为0.4 mol/L |
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) 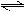 4NO2(g)+ O2(g);△H >0,T1温度下的部分实验数据如下表.下列说法不正确的是
4NO2(g)+ O2(g);△H >0,T1温度下的部分实验数据如下表.下列说法不正确的是
| t/s |
0 |
500 |
1000 |
1500 |
| c(N2O5)mol/L |
5.00 |
3.52 |
2.50 |
2.50 |
A.500s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1 =125,1000s时转化率为50%
C.其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1 <T2
D.T1温度下的平衡常数为K1 ,T3温度下的平衡常数为K3,若K1> K3,则T1>T3
温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。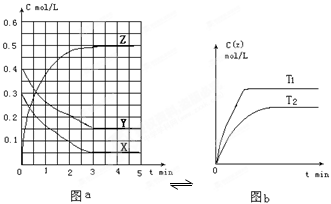
下列叙述正确的是
| A.该反应的正反应是放热反应 |
| B.T0时,该反应的平衡常数为1/3 |
C.图a中反应达到平衡时,Y的转化率为37.5% |
D.反应时各物质的反应速率关系为:2v(X)=2v(Y)=v(Z)  |
某温度下,在一容积可变的恒压密闭容器里,反应3A(g)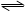 B(g)+3C(g)达到平衡时,A、B、C的物质的量分别是6mol,2mol,6mol.在保持温度和压强不变的条件下,下列说法正确的是
B(g)+3C(g)达到平衡时,A、B、C的物质的量分别是6mol,2mol,6mol.在保持温度和压强不变的条件下,下列说法正确的是
A.充入1mol的He(He与容器里的气体不反应),平衡不移动
B.充入A、B、C各2mol,平衡将向正反应方向移动
C.将A、B、C各减少1mol,达平衡后C的百分含量增加
D.加入一定量的A气体达平衡后,C的百分含量一定增加