设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.常温常压下,16 g O2含有nA个氧原子 |
| B.1mol苯含有3nA个碳碳单键和3nA个碳碳双键 |
| C.一定条件下,3molH2和1molN2充分反应后,可得到2nA个NH3分子数 |
| D.1 mol·L-1 FeCl3溶液中含有Cl-总数为3nA |
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A.在铜与硫的反应中,1 mol铜参加反应失去的电子数目为2NA |
| B.1.5 molNO2与足量H2O反应,转移的电子数为2NA |
| C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA |
| D.0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1NA |
制备单质硅时,主要化学反应如下
① ②
② ③
③ 下列对上述三个反应的叙述中,不正确的是( )
下列对上述三个反应的叙述中,不正确的是( )
| A.①③为置换反应 | B.①②③均为氧化还原反应 |
| C.②为化合反应 | D.三个反应的反应物中硅元素均被氧化 |
化学知识在生产和生活中有着重要的应用。下列说法中,错误的是( )
| A.与铜质水龙头连接处的钢质水管易发生腐蚀 |
| B.明矾常作为净水剂,双氧水通常可用于作杀菌消毒 |
| C.金属钠、镁等活泼金属着火时,可以使用泡沫灭火器来灭火 |
| D.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 |
“喷水溶液法”是最近日本科学家研制出的一种使沙漠变绿洲的新技术,它是先在沙漠中喷洒一定量的聚丙烯酸酯水溶液,水溶液中的高分子与沙土粒子结合,在地表下30~50 cm处形成一个厚0.5 cm的隔水层,既能阻止地下的盐分上升,又有拦截、蓄积雨水的作用,下列对聚丙烯酸酯的说法不正确的是( )
| A.单体的结构简式为CH2===CH—COOR |
| B.在一定条件下能发生加成反应 |
| C.在一定条件下能发生水解反应 |
| D.有固定的熔沸点 |
聚合物要能导电,其内部的碳原子之间必须交替的以单键和双键结合,同时还必须掺杂处理才能成为真正的导电聚合物.下列高分子材料可能具有导电性的是( )
A.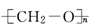 |
B.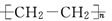 |
C. |
D.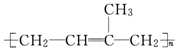 |