水田或池塘里常常不时地冒出一些气泡,几位同学决心弄清这种气泡的成分。请你与他们一起完成如下的探究:
【对气体猜想】
猜想I:全部是CH4; 猜想Ⅱ:全部是CO2; 猜想Ⅲ:是CH4和CO2的混合气体。
【气体的收集】
他们设计了如右图所示的取气方法:将空的雪碧汽水塑料瓶装满水,倒放在池塘中,瓶口对准水底冒出的气泡收集。这种集气方法叫 。针对瓶口太小不便于收集的特点,在不换瓶的情况下你的改进方法是 。
【实验和推断】
如图1,将雪碧瓶(A)中收集到的气体依次通入B、C中,在D处点燃。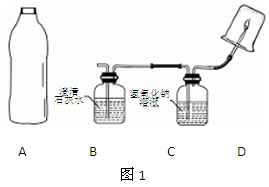
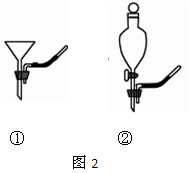
(1)要将A中的气体通入后面的装置中,应选图2中的 (填序号)“注水装置”。(2)若B中石灰水变浑浊,则说明A中的气体中含有 气体。
(3)装置C作用是 。
(4)若D处倒扣的是涂有澄清石灰水的烧杯,出现浑浊,且B中无明显现象,则“猜想 ”成立。若D处倒扣的是干冷的大烧杯,杯壁有水雾出现,有同学认为“猜想I、Ⅲ”可能成立,另有同学认为此现象不能证明收集到的气体中一定含有CH4,理由是气体通过B、C装置时,会带入水蒸气,要排除这种干扰可采取的措施是 。
(5)采取(4)中的排除干扰措施后,若D处分别倒扣干冷的烧杯和涂石灰水的烧杯,分别出现水雾和浑浊,且B中也出现浑浊,则证明“猜想 ”成立。
某学习小组在探究“酸的化学性质”时,做了如图所示的A、B两个实验.分别向氢氧化钠和碳酸钠溶液中加入一定质量的稀硫酸,反应结束后,把废液倒入同一个废液缸中,观察到废液缸中产生少量气泡.请回答下列问题: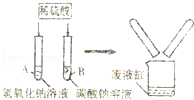
(1)试管A中的化学方程式是 ,在实验过程中并没有观察到该反应的明显现象,请你写出一种能观察到变化发生的方法 (2)通过分析废液缸中的现象,你认为B试管的废液中溶质成分是 (填化学式,下同);
(3)小组同学对废液缸中最终废液的成分进行探究,请你一起参与探究.
【提出问题】最终废液中溶质是什么?
【查阅资料】硫酸钠溶液显中性.
【假设猜想】猜想①:Na2SO4
猜想②:Na2SO4、Na2CO3
猜想③:
【实验探究】请你设计实验,确定哪个猜想是正确的.
| 实验步骤 |
实验结论 |
|
| |
|
猜想1正确 |
| |
猜想2正确 |
|
| |
猜想3正确 |
利用金属和某些溶液能否发生置换反应可以确定金属活动性顺序.为了验证铝、铁、铜的金属活动性顺序,某同学设计了两个合理方案,所需试剂如下:
方案一:铝片、 、铜片;
方案二:铝粉、氯化亚铁溶液、硫酸铜溶液.
(1)方案一中缺少的试剂可以是 ;
(2)写出方案二的实验操作步骤、预期现象和反应的化学方程式.
同学们在学习酸和碱的化学性质时,进行了如图所示的实验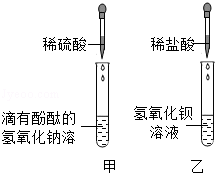
(1)甲实验中能证明两种物质发生反应的明显现象是
(2)实验结束后,同学们将甲、乙两个实验所得的无色废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色
【提出问题】废液中含有哪些物质?
【交流讨论】①一定含有的物质:硫酸钡、指示剂、水、碱类物质和 (写化学式或名称)
②对碱类物质是什么?同学们有如下猜想
猜想一:只有氢氧化钠
猜想二:只有氢氧化钡
猜想三:是氢氧化钠和氢氧化钡
你认为猜想 是错误的
【实验设计】若要证明剩余的两种猜想,可选用的试剂是
(1)如图是实验室制取二氧化碳并验证其性质的装置图,回答: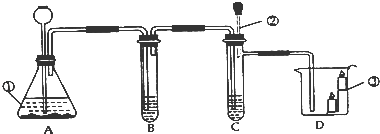
①A是实验室制取二氧化碳的装置,内装药品为 ;
②B的试管中装有滴有紫色石蕊的蒸馏水,现象为 ;
③装置C中有澄清石灰水,其中发生化学反应的化学方程式为 ;
④装置D中有两支高低不同的燃着的蜡烛,可观察低处的蜡烛先灭,高处的蜡烛后灭,说明二氧化碳
具有 性质。
(2)实验室有一瓶化肥的标签已脱落,只知道它是NH4Cl、(NH4)2SO4、NH4HCO3和尿素[CO(NH2)
2]中的一种,请你完成以下探究:
[猜想]猜想A:该化肥是NH4Cl,猜想B:该化肥是(NH4)2SO4,猜想C:该化肥是NH4HCO3,猜
想D:该化肥是尿素。
[实验探究]
(Ⅰ)取少量样品在研钵中与熟石灰研磨,有刺激性气味的气体放出,证明猜想 不成立。
(Ⅱ)如图(甲),分别取少量样品于试管中,滴加适量水振荡,再选(乙)中 溶液滴入试管
中,若无气泡放出,则猜想 不成立。
(Ⅲ)在步骤(Ⅱ)的试管中再滴入(乙)中的 溶液,若 ,则猜想A成立;若 ,则猜想B成立,其反应的化学方程式为: (注:乙图中药品为食盐、氯化钡、盐酸三种溶液)。
珍珠粉以其良好的养颜等功效,获得消费者喜爱。资料显示:珍珠中含碳酸钙80﹣93%、蛋白质4﹣14%、水份2﹣4%、十几种氨基酸、28种微量元素.然而一些不法分子用回收的贝壳加上工业用氢氧化钠配制的药水进行清洗、晾晒以后直接加工销售,其主要成分是:碳酸钙,及少量残留氢氧化钠.以下是某化学兴趣小组设计辨别真假珍珠,并测定珍珠中碳酸钙含量的实验探究方案。
【探究一】辨别市售珍珠真与假。
将其分别溶于水,充分搅拌、静置,测定上层清液的pH;若pH 7(填“>”或“<”或“=”)为假珍珠,理由是 。
【探究二】测定珍珠中碳酸钙含量。
小王用如图所示装置测定该珍珠粉中碳酸钙的含量,实验方案如下: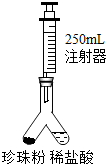
(1)检查装置气密性:按图1连接装好置后,将注射器活塞(规格为250mL,不考虑活塞的摩擦和自重,下同)从刻度10mL处向上拉至刻度20mL处, (填操作和现象),则气密性良好;(2)在图1异型装置左管内装入1.1g 上述珍珠粉样品,右管内倒入一定量的稀盐酸,注射器活塞推到底部,再次连接装置;
(3)设法使左右两管内的药品混合,反应结束后读取注射器读数为220mL;
(4)数据处理:计算得该珍珠粉中碳酸钙的质量分数为 。[ρ〔CO2〕=2g/L,结果保留小数点后1位]
【实验思考】((1)此实验中的反应原理是 (用化学方程式表示);
(2)考虑注射器因素,该实验方案对珍珠粉的用量多少是否必须作要求? ;
(3)【探究二】中的第(3)步,混合两种药品的方法是 ;
(4)该实验装置设计上的优点在于 (写出1点即可)。