短周期主族元素A、B、C、D,原子序数依次增大。A.C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.原子半径:A<B<C<D B.单质B常温下能溶于浓硝酸
C.最高价氧化物对应水化物的酸性:D<C D.非金属性:A>C
在下列物质中,只有在溶液状态才能导电的电解质是()
| A.NaCl | B.酒精 | C.H2SO4 | D.SO3 |
下列离子方程式正确的是()
A.碳酸钙和盐酸反应: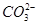 +2H+=H2O+CO2↑ +2H+=H2O+CO2↑ |
B.向氢氧化钡溶液中加硫酸溶液:Ba2++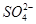 =BaSO4↓ =BaSO4↓ |
| C.向氯化铜溶液中加铁粉:Cu2++Fe=Cu+Fe2+ |
| D.向稀盐酸溶液中加铁:2Fe+6H+=2Fe3++3H2↑ |
下列关于胶体的说法正确的是()
| A.胶体外观不均匀 | B.胶粒不能透过滤纸 |
| C.胶体一定是混合物 | D.胶体一定是液体 |
下列叙述正确的是()
| A.氧化还原反应的本质是元素化合价发生了改变 |
| B.氧化还原反应中氧化剂发生了氧化反应 |
| C.氧化剂在同一反应中既可以是反应物,也可以是生成物 |
| D.有单质参加的化合反应一定是氧化还原反应 |
下列分散系能发生丁达尔效应的是()
| A.CH3CH2OH水溶液 |
| B.雾 |
| C.含有尘埃的空气 |
| D.饱和食盐水 |