(1)在实验室里可以用浓盐酸跟二氧化锰起反应制取氯气,反应的化学方程式为:______________________________________________________。
(2)往过氧化氢溶液中加入二氧化锰粉末可以产生氧气,此反应中二氧化锰的作用是_____________。
(3)在SO2、CaO、D2、HCl、Na2CO3五种纯物质中,属于共价化合物的是_________________________;含非极性键的是_______________。
(4)已知:2 SO2 + O2 2 SO3。向一密闭容器中充入SO2与18O2,反应一段时间后,含18O的物质是_______________________。
2 SO3。向一密闭容器中充入SO2与18O2,反应一段时间后,含18O的物质是_______________________。
(5)如下反应:
① Zn + CuSO4 = ZnSO4 +Cu ② NaOH + HCl =" NaCl" + H2O
③ 4Al + 3O2 = 2Al2O3 ④ Na2CO3 + H2SO4 = Na2SO4 + CO2↑+ H2O
其中可以设计成原电池的是_______________(写序号)。
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快。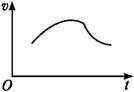
(1)反应开始时反应速率加快的原因是 ;
(2)反应后期反应速率减慢的原因是 。
测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式 。
(2)判断滴定终点的方法是 。
(3)计算:血液中含钙离子的浓度为 g·mL-1。
某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL; |
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写) 。
(2)上述B步骤操作的目的是 。
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果 (填“偏高”“偏低”或“不变”)。
(4)判断到达滴定终点的实验现象是 。
如下图是常见仪器的部分结构。
(1)写出仪器名称A ,B ,C ,D 。
(2)使用前需检查是否漏水的仪器有 。
一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸(用a、b、c回答)。
(1)当其物质的量浓度相同时。c(H+)由大到小的顺序是 ,pH由大到小的顺序是 。
(2)同体积、同物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是 。
(3)当c(H+)相同时,物质的量浓度由大到小的顺序为 。
(4)当pH相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序为 。