①~⑩十种元素,在元素周期表中的位置如图所示。回答下列问题: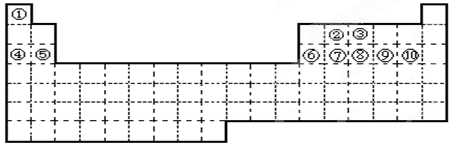
(1)在上述十种元素中,置换酸中氢的能力最强的元素为 (填化学符号,下同);最高价氧化物的水化物的酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ;原子半径最大的元素是 ,半径最小的离子是 。
(2)上述十种元素中,金属性最强的元素在周期表中的位置是第 周期 族,该元素的单质在空气中燃烧的化学方程式为 。
(3)试用电子式表示元素①和③形成分子的过程 。
以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的是
(填序号),写出反应⑥的化学方程式______。
Li-SOC12电池可用于心脏起搏器,该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2.电池的总反应可表示为:4Li+2SOC12  4LiCl +S+SO2。
4LiCl +S+SO2。
请回答下列问题:
(1)电池的负极材料为_________,发生的电极反应为____________________;
(2) SOCl2易挥发,实验室中常用NaOH溶液吸收SOC12,如果把少量水滴到SOCl2中,反应的化学方程式为__________________________________________;
(3)用此蓄电池电解含有0.1 mol/LCuSO4和0.1 mol/LNaCl的混合溶液100 mL,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是______L,将电解后的溶液加水稀释至1L,此时溶液的pH=______________。
A、B、C、D、E、F为原子序数依次增大的六种元素。已知:A是周期表中原子半径最小的元素,B的基态原子核外电子有7种运动状态,B、C、E三种元素原子中未成对电子数之比为3:2:l,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子。回答下列问题:
(1)写出下列元素的名称:B______ C_____ E_______
(2)F在元素周朔表的位置是_________,与F同周期且未成对电子数最多的元素为______(填写元素符号),该元素基态原子的核外电子电子排布式为__________;
(3)B与D组成的化合物可以与水反应,写出它与水反应的化学方程式______________。
水的电离平衡曲线如图所示:
(1)A点表示25℃时水电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态变到B点,则100℃时水的离子积为_____________。
(2) 100℃时,若10体积的某强酸溶液与l体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pHa与强碱的pHb之间应满足的关系是______________。
运用物质结构的知识完成下列问题。
(1)第一电离能介于B、N之间的第二周期元素有(填元素符号)。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,配体的化学式为。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
Q R
①晶体Q中不存在的作用力为(填字母)。
A.共价键 B.离子键 C.配位键 D.范德华力 E.氢键
②R中阳离子的空间构型为。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm—(含B、O、H三种元素)的球棍模型如下图3所示。则m=(填数字)。
(5)以四氯化钛、碳化钙、叠氮酸盐(如NaN3)作原料,可以生成碳氮化钛化合物,其结构是用碳原子取代氮化钛晶胞(结构如下图4)所有顶点的氮原子,这种碳氮化钛化合物的化学式为。

图3图4
(6)部分化学键的键能见下表:
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
| 键能/ kJ·mol—1 |
460 |
360 |
436 |
431 |
176 |
347 |
①比较下列两组物质的熔点高低 (填“>”或“<”) SiC______ Si; SiCl4 ______ SiO2
②工业上高纯硅可通过下列反应制取:SiCl4 (g) + 2H2(g) 高温Si(s) + 4HCl(g)
计算该反应的反应热△H =___________ kJ/mol。