现有一包AlCl3和FeCl3的混合粉末,欲将其中的Al元素和Fe元素分开,可进行如下操作:
(1) 操作①名称是 ,操作②名称是 (过滤/分液/蒸馏/溶解/结晶);
(2)溶液B是 ,沉淀C是
(3)若往溶液A中滴入KSCN溶液,预计会观察到溶液呈 色;
(4)请写出在溶液中,FeCl3和NaOH反应的离子方程式:
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 一 |
① |
|||||||
| 二 |
② |
③ |
④ |
⑤ |
||||
| 三 |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
(1) 在这些元素中,化学性质最不活泼的是:(填元素符号)。
(2) 元素②和③非金属性较弱的是___________(填元素符号),画出元素③原子结构示意图_______________________。
(3) ④和⑧气态氢化物的稳定性较强的是_____________(填化学式)。
(4) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是___________,碱性最强的化合物的电子式是___________________。
(5)用电子式表示元素①和⑤所形成化合物的形成过程:________________________。
(6)⑤⑥⑦三种元素分别形成的单核离子半径由大到小顺序为________________(填离子符号)。
(7)元素①和④按原子个数比1:1形成的化合物分解的化学方程式_________________。
(8)写出元素⑦和⑨最高价氧化物的水化物之间反应的离子方程式_________________。
已知:①具有一个甲基支链的化合物A的分子式为C4H6O2,A可以使Br2的四氯化碳溶液褪色,1molA和1mol NaHCO3能完全反应。②化合物B含有C、H、O三种元素,相对分子质量为60,其中碳的质量分数为60%,氢的质量分数为13.3% 。B在催化剂Cu的作用下被氧气氧化成C,C能发生银镜反应。③A和B在浓硫酸加热条件下可生成有水果香味的D。回答下列问题:
(1)写出与A具有相同官能团的A的所有同分异构体的结构简式:
(2)C所具有的官能团名称为
(3)A和B生成D的化学方程式是:
化学工作者和广大消费者十分关注聚氯乙烯保险膜的安全问题。工业上用乙烯和氯气为原料经过下列各步反应合成聚氯乙烯: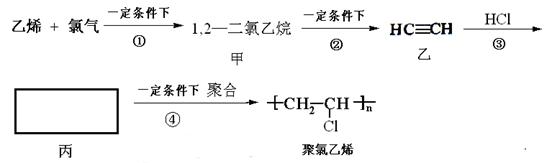
(1)乙烯是来自石油的重要有机化工原料,目前工业上生产乙烯主要以石油为原料通过__________反应来实现。
(2)反应①的化学方程式为:。
(3)有机物乙是乙炔,结构中的碳碳三键是比碳碳双键更不饱和的键,推测乙炔具有的性质(写出一点即可)。
(4)丙是聚氯乙烯的单体,其结构简式为 。
。
(14分)纳米材料二氧化钛(TiO2)可做优良的催化剂。
| 资料卡片 |
||
| 物质 |
熔点/℃ |
沸点/℃ |
| SiCl4 |
-70 |
57.6 |
| TiCl4 |
-25 |
136.5 |
Ⅰ. 工业上二氧化钛的制备方法:
①将干燥后的金红石(主要成分为TiO2,主要杂质 SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
②将SiCl4分离,得到纯净的TiCl4。
③在TiCl4中加水、加热,水解 得到沉淀TiO2·xH2O。
得到沉淀TiO2·xH2O。
④ TiO2·xH2O高温分解得到TiO2。
(1) 根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是____________,分离二者所采取的操作名称是________________。
(2) ③中反应的化学方程式是__________________________________。
Ⅱ. 据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2→2O b. O+H2O→2OH c. OH+OH→H2O2
(3) b中破坏的是______________(填“极性共价键”或“非极性共价键”)。
(4) H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的____________(填“氧化性”或“还原性”)。
Ⅲ. 某研究性学习小组用下列装置模拟“生态马路”清除CO的原理。(夹持装置已略去)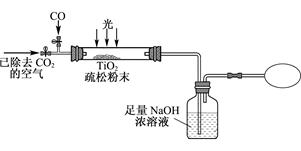
(5) 若缓慢通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为____________。
(6) 当CO气体全部通入后,还要通一会儿空气,其目的是。
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。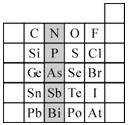
(1)阴影部分元素N在元素周期表中的位置为。
根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为______,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度(选填“更大”、“更小”或“相同”) 。
(3)O原子与氢原子可 形成10电子阴离子,写出该
形成10电子阴离子,写出该 阴离子的电子式
阴离子的电子式
(4)Cl2、Br2、I2均可从中海洋提取,Br2的提取是采用向酸化的浓海水中通入Cl2置换出Br-的方法而获得,有关的离子方程式为,利用Br2具有较强的氧化性,S O2具有较强的还原性,将吹出的Br2通入溶有SO2气体的溶液中,进行溴的富集,此时溶液中存在的主要离子是____________________________。
O2具有较强的还原性,将吹出的Br2通入溶有SO2气体的溶液中,进行溴的富集,此时溶液中存在的主要离子是____________________________。