“绿色化学”是当今社会提出的一个新概念。在“绿色化学工艺中,理想状态是反应物中原子全部转化为欲制的产物,即原子的利用率为100%。在用丙炔合成甲基丙烯酸甲酯( )的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
)的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
| A.CO和CH3OH | B.CO2和H2O | C.H2和CO2 | D.CH3OH和H2 |
常温下,下列溶液中有关物质的量浓度关系和计算不正确的是()
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:
c(NH4Cl) ﹥c[(NH4)2SO4]﹥c[(NH4)2Fe(SO4)2]
B.已知25°C时Ksp(AgCl)=1.8×10-10,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH约为1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有C(HA-) >C(H+)>C(A2-)>C(H2A)
下列相关反应的离子方程式书写正确的是( )
| A.4molFe 在5molCl2中点燃反应:5Cl2+4Fe=2FeCl2+2FeCl3 |
| B.氯化铁溶液中通入硫化氢:2Fe3++H2S=2Fe2++S↓+2H+ |
| C.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
| D.NaHCO3溶液中加入过量的Ba(OH)2溶液: |
2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32-
NA表示阿伏加德罗常数,下列说法正确的是()
| A.1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子 |
| B.1 mol Al分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA |
| C.各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
| D.24 g镁与足量的盐酸或NaOH溶液反应转移的电子数目均为2NA |
amolFeS与bmolFe3O4投入到VL cmol/L的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为( )
A.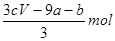 |
B.(a+3b)mol | C.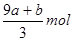 |
D.(cV-3a-9b)mol |
做实验时不小心粘了一些高锰酸钾,皮肤上的斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为: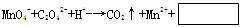
关于此反应的叙述正确的是 ( )
| A.该反应的氧化剂是C2O42- |
| B.该反应右边方框内的产物是OH- |
| C.该反应中生成1molCO2电子转移数总是5NA |
| D.配平该反应式后,H+的系数是16 |