下图是氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图,根据要求回答问题。
资料卡:通空气时发生的反应为:4Fe(OH)2+ 2H2O + O2 =" 4" Fe(OH)3,由沉淀获得Fe3O4 的过程中发生的反应为Fe(OH)2 + 2 Fe(OH)3 Fe3O4 + 4H2O,
的过程中发生的反应为Fe(OH)2 + 2 Fe(OH)3 Fe3O4 + 4H2O,
(1)在实验室里进行过滤操作时,通常要使用的玻璃仪器有烧杯、玻璃棒和 。
(2)由溶液N获得该副产品的操作顺序是b→ → →d。
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
则副产品P是 。
(3)流程中控制“一定量空气 ”的目的是 。
我国家用能源的发展已经进入到了燃气时代。小华在家里打开煤
气罐(内装液体燃料)时,听到“咝咝”的声音。请用分子的观点解释这一现象:。如果你是小华,在家里你检测燃气是否泄漏的简单方法是为了便于提醒用户煤气是否泄漏,国家统一规定必须在燃气中加入乙硫醇(化学式为C2H6S)。请说出乙硫醇可能具有的性质(至少两条)。
(2)刘菲为同学们表演了一组魔术,她在3个盛有相同液体的玻璃杯(分别编号A、B、C)中,分别倒入三种不同的液体,同学们看到下列奇特现象:A杯变成红葡萄酒,B杯变成“汽水”(有大量气体生成),C杯变成“牛奶”(有白色浑浊)。请你给刘菲揭开魔术的秘密。
①B杯中生成的气体可能是(填化学式)。
②写出C杯中可能发生反应的化学方程式:。
下图是甲、乙两种固体物质的溶解度曲线。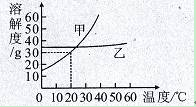
(1)30℃时,甲的溶解度(填“大于”、“等于”或“小于”)乙的溶解度。
(2)要使饱和甲溶液变为不饱和溶液,可采取的方法是(只填一种)。
(3)在20℃时,把甲、乙各10g固体分别加入到两个盛有50g水的烧杯中,充分搅拌,所得甲溶液为(填“饱和”或“不饱和”)溶液;若将温度都升高到30℃,甲溶液中溶质的质量分数(填“大于”、“等于”或“小于”)乙溶液中溶质的质量分数。
(4)10℃时,向12%的100g甲溶液中加水60g,可得到溶液g,此时溶质的质量分数为 %。
NO和NO2具有下列不同的性质:
(1)通常情况下,NO是无色气体,难溶于水;NO2是红棕色气体,易溶于水。
(2)NO2与水反应的化学方程式为3NO2+H2O=2HNO3+NO。如下图,将一支充满NO2气体的试管倒立在烧杯中,试分析反应完全后可能出现的实验现象:、
、。
生活中处处有化学。你知道下列化学原理吗?
(1)使用久了的水壶内壁会形成水垢,在家里可用浸泡除去。
(2)白糖与红糖的主要成分都是蔗糖,利用活性炭的性,将红糖脱色变成白糖。
(3)生产和生活中的许多物质都含有一定的杂质(括号内为杂质)。下面的除杂方法中,完全正确的是。
| 选项 |
物质 |
除杂方法 |
| a |
Fe粉 (Fe2O3粉末) |
①加入适量稀盐酸; ②灼热的木炭 |
| b |
CO2(CO) |
①点燃;②澄清石灰水 |
| c |
KCl溶液 (K2CO3溶液) |
①加入适量稀盐酸; ②加入适量BaCl2溶液 |
| d |
KNO3晶体 (NaCl) |
①溶解,降低温度,过滤; ②加入过量AgNO3溶液 |
(4)选择一种物质,均能除去下列各组物质中的杂质(括号内为杂质),该物质是。
①C(CuO)②Ag(Mg)③HCl(BaCl2)④NaCl [Ba(OH)2]
现有下列六种物质:①葡萄糖;②熟石灰;③酒精;④硝酸钾;⑤硝酸铵;⑥氯化钠,请从其中选择适当的物质,用其化学式填空。
可用于改良酸性土壤的是;
农业上可作复合肥料的是;
生活中常用的调味品是。