下图是甲、乙两种固体物质的溶解度曲线。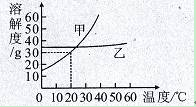
(1)30℃时,甲的溶解度 (填“大于”、“等于”或“小于”)乙的溶解度。
(2)要使饱和甲溶液变为不饱和溶液,可采取的方法是 (只填一种)。
(3)在20℃时,把甲、乙各10g固体分别加入到两个盛有50g水的烧杯中,充分搅拌,所得甲溶液为 (填“饱和”或“不饱和”)溶液;若将温度都升高到30℃,甲溶液中溶质的质量分数 (填“大于”、“等于”或“小于”)乙溶液中溶质的质量分数。
(4)10℃时,向12%的100g甲溶液中加水60g,可得到溶液 g,此时溶质的质量分数为 %。
某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰。该小组同学进行了如下探究。

 (1)写出铁丝在氧气中燃烧的化学方程式:————————————————————————————————。
(1)写出铁丝在氧气中燃烧的化学方程式:————————————————————————————————。 (2)探究一:蜡烛燃烧产生火焰的原因是什么?
(2)探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也
有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由————————
(填“固态”或“气态”)物质燃烧形成的。
(3)探究二:物质燃烧产生火焰的根本原因是什么?
【查阅资料】
| 物质 |
熔点╱℃ |
沸点╱℃ |
燃烧时温度╱℃ |
| 石蜡 |
50∽70 |
300∽550 |
约600 |
| 铁 |
1535 |
2750 |
越1800 |
| 钠 |
97、8 |
883 |
越1400 |
由上表可知:物质燃烧能否产生火焰与其(填“熔点”或“沸点”)和燃烧时温度有关。由此推测:钠在燃烧时,(填“有”或“没有”)火焰产生。
(4)木炭在氧气中燃烧没有火焰,但生活中木炭燃烧时会产生火焰,其原因可能是——————
。
(10长春中考17.)请回答有关金属活动性的问题:(1)在Mg和Fe中,活动性较强的是;
(2)Mn的活动性比Fe强,由此可知Mn与稀盐酸(选填:“能”或“不能”)反应;
(3)用Fe和一种盐溶液验证Fe比Cu活泼,写出反应的化学方程式。
(10咸宁32).为探究Al、Fe、Cu三种金属的活动性顺序,有甲、乙、丙三位同学设计了如下方案:
(1)甲同学将金属分别放入盛有盐酸的3支试管中。根据铜加入盐酸中无变化,现象,判断出Al>Fe>Cu。
(2)乙同学只用一支试管,只取一次盐酸也能证明Al>Fe>Cu,他在盐酸中插入金属的顺序是Fe。
(3)丙同学只调整了乙同学插入盐酸中金属的顺序,也能得到正确结论。丙同学调整金属的顺序为。
【拓展应用】在CuCl2和AlCl3的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中加入盐酸,无明显现象,则滤液中一定含有的溶质是。
(10江西22)(3分)小思实验操作考试的题目是探究金属的化学性质,内容包括:铜在空气中灼烧、锌与稀硫酸反应、铝丝与硫酸铜溶液反应。下图是他实验操作考试中的部分情景。 
(1)上图中有一处错误的操作,该操作是;(填序号)
(2)操作A的现象是;
(3)他讲铝丝插入到硫酸铜溶液中,未出现任何现象,其原因是。
(10宜昌22).金属活动性顺序在运用中给我们三条判断依据,即在金属活动性顺序里:
⑴金属的位置越靠前它的活动性就越强;
⑵位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
⑶位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。通过查阅资料我发现金属铝与氧化铜在高温条件下能发生置换反应,其化学方程式为,由此我发现了一条新的判断依据。