某短周期元素最外层只有2个电子,则该元素一定是
| A.第1、2或3周期元素 | B.最高正价为+2 |
| C.IIA族元素 | D.金属元素 |
烷基取代苯 可以被KMnO4的酸性溶液氧化生成
可以被KMnO4的酸性溶液氧化生成 ,但若烷基R中直接与苯环连接的碳原子上无C-H键,则不被氧化,现有分子式是C12H18的二烷基取代苯则它可以被氧化为
,但若烷基R中直接与苯环连接的碳原子上无C-H键,则不被氧化,现有分子式是C12H18的二烷基取代苯则它可以被氧化为 的异构体有
的异构体有
| A.13种 | B.14种 | C.15种 | D.16种 |
下列各组烃的混合物,只要总质量一定,按任意比例混合,完全燃烧后生成的CO2和H2O都是恒量的是
| A.C2H2、C2H4 | B.C2H4、C4H6 |
| C.C2H6、C3H6 | D.C6H6、C2H2 |
下列有机物的命名正确的是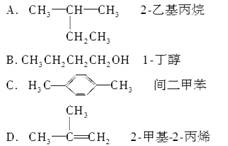
下列说法中,正确的是
| A.分子组成相差一个或几个CH2原子团的物质互为同系物,它们有相似的化学性质和不同的物理性质 |
| B.不带支链的烃,其分子是直线形的 |
| C.甲烷是烷烃中碳含量最低的,也是组成最简单的烃 |
| D.分子式为C4H10的烃有3种 |
下列事实与氢键有关的是
| A.水加热到很高温度都难以分解 |
| B.水结成冰体积膨胀,密度变小 |
| C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
| D.HF、HCl、HBr、HI的热稳定性依次减弱 |