研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。如下图所示,下列叙述正确的是( )

| A.阳极产生的气体为氟气 |
| B.阳极区放出的气体一定只有纯氧气 |
| C.TiO2在阴极表面放电 |
| D.制备金属钛前后,CaO的总量不变 |
一定温度下,向饱和NaOH溶液中加入一定量的钠块,充分反应后恢复到原温度,下列说法正确的是
| A.溶液中溶质质量增加,溶剂质量减少,溶液中溶质的质量分数变大 |
| B.溶液的pH不变,有氢气放出 |
| C.溶液中的Na+数目减小,有氧气放出 |
| D.溶液中的c(Na+)增大,有氧气放出 |
在K2CO3样品中含Na2CO3、KNO3、Ba(NO3)2中的一或二种杂质.将13.8 g该样品溶于足量水中得到澄清溶液,再加入过量CaCl2溶液,可得9.0 g沉淀,则原样品中含有的杂质会是
| A.肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3 |
| B.肯定有Na2CO3,没有Ba(NO3)2 |
| C.肯定没有Na2CO3,Ba(NO3)2 |
| D.无法判断何种为肯定或否定的杂质 |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl; 2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是
| A.酸性(水溶液):HSCN > H2CO3 > HCN |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2 |
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数之比为2:3:3,向溶液中通入氯气,使溶液中Cl-和Br-的个数比为7:3(已知还原性I->Fe2+>Br->Cl-),则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为
| A.5:4 | B.4:5 | C.5:12 | D.12:5 |
下图是a、b两种固体物质的溶解度曲线,下列说法中,正确的是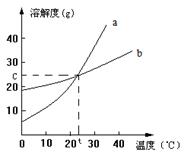
| A.a的溶解度大于b的溶解度 |
| B.在t℃时,a、b的饱和溶液中溶质的物质的量浓度相同 |
| C.当a中含有少量b时,可以用冷却结晶法提纯a |
| D.在t℃时,将a、b的饱和溶液升温后,溶质的质量分数:a﹥b |