下列是25 ℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
| 化学式 |
AgCl |
Ag2CrO4 |
CH3COOH |
HClO |
H2CO3 |
| Ksp或Ka |
Ksp=1.8×10-10 |
Ksp=9.0×10-12 |
Ka=1.8×10-5 |
Ka=3.0×10-8 |
Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO-+CO2+H2O=CO32-+2HClO
C.向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的pH=5
D.向浓度均为1.0×10-3 mol·L-1的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol·L-1的AgNO3溶液,CrO42―先形成沉淀
某有机物的结构简式为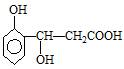 ,它可发生的反应类型有
,它可发生的反应类型有
①取代②加成③消去④水解⑤酯化⑥中和⑦氧化⑧加聚
| A.①②③⑤⑥ | B.②③④⑤⑧ |
| C.①②③⑤⑥⑦ | D.③④⑤⑥⑦⑧ |
具有单双键交替长链(如:-CH=CH-CH=CH-CH=CH-)的高分子有可能成为导电塑料。2000年诺贝尔化学奖即授予开辟此领域的3位科学家。下列高分子中可能成为导电塑料的是
| A.聚乙烯 | B.聚乙炔 | C.聚苯乙烯 | D.聚丁二烯 |
下列物质中不属于卤代烃的是
| A.CH2Cl2 | B.CCl2F2 | C. —Br | D.CH3COCl |
下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是
甲苯与苯相比较,下列叙述中不正确的是
| A.常温下都是液体 | B.都能使酸性高锰酸钾溶液褪色 |
| C.都能在空气燃烧 | D.都能发生取代反应 |