某有机物的结构简式如图所示,有关该物质的说法正确的是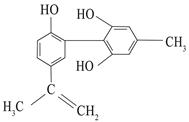
| A.该分子的分子式为C16H18O3 |
| B.该分子中的所有氢原子可能共平面 |
| C.滴入酸性KMnO4溶液,可观察到紫色褪去,能证明结构中存在碳碳双键 |
| D.1mol该物质与H2反应时最多消耗H2 为7 mol |
下列叙述正确的是
| A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
B.2SO2(g) + O2(g) 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用下图表示 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用下图表示 |
C.2NO+2CO 2CO2+N2的ΔH<0,常温下该反应一定能自发进行 2CO2+N2的ΔH<0,常温下该反应一定能自发进行 |
| D.25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 |
下列事实能说明NH3·H2O一定是弱电解质的是
①常温下,NH3·H2O溶液能使酚酞变红;
②用NH3·H2O溶液做导电性实验,灯泡很暗;
③常温下,0.1mol / L氯化铵溶液的pH约为5;
④常温下,体积相同且pH相同的NH3·H2O溶液和NaOH溶液,与相同浓度的HCl溶液中和时,消耗HCl溶液的体积:前者>后者
| A.①②③④ | B.②③④ | C.③④ | D.②④ |
下列大小关系比较正确的是
| A.离子半径:F-<Na+<Mg2+ |
| B.电负性:C<O<N |
| C.氢化物的沸点:NH3<PH3<AsH3 |
| D.碱性: NaOH)>Mg(OH)2> Al(OH)3 |
设NA为阿伏伽德罗常数的值,下列叙述正确的是
| A.0.5 L 1 mol/L NaHS溶液中,N(Na+)+N(HS—)=NA |
| B.12.4 g白磷(分子式为P4)中含有P—P共价键0.6 NA |
| C.常温下,pH=2的醋酸溶液中所含有的H+数为0.01 NA |
| D.将92 g N2O4晶体放入容器中,恢复到常温常压时,所含气体分子数为NA |
下列离子方程式中,正确的是
| A.用惰性电极电解MgCl2溶液:2Cl—+H2O通电 2OH—+Cl2↑+H2↑ |
B.碳酸钠溶液显碱性:CO32—+H2O HCO3—+OH— HCO3—+OH— |
C.氯气通入冷水中:Cl2 +H2O  Cl- +ClO- +2H+ Cl- +ClO- +2H+ |
| D.碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH= 2CH3COO-+CO2↑+H2O |