一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,
发生如下反应:CO (g) 十H2O (g)  CO2 (g) 十 H2 (g) ; △H<0
CO2 (g) 十 H2 (g) ; △H<0
(1)在850℃时,CO和H2O浓度变化如下左图,则 0~4min的平均反应速率v(CO2)= _mol·L-1·min-1
(2)t1℃时,在相同容器中发生上述反应,各物质的浓度变化如右上表:
① 计算t1℃该反应的平衡常数为K = 。
② t1℃时,反应在5min~6min间,平衡 移动(填向左、向右或不 ),若在第5分钟改变一种条件达到第6分钟的浓度,改变的条件是 ________。
(3)t2℃时,化学反应CO (g) + H2O (g)  CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃,判断依据是:
CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃,判断依据是:
有:①168O、188O ②H2O、D2O③O2、O3三组微粒或物质,其中互为同位素的是(填序号,下同),互为同素异形体的是
(12分)人们对苯及芳香烃的认识有一个不断深化的过程。
(1)已知分子式为C6H6的结构有多种,其中的两种为:
①这两种结构的区别表现在定性方面(即化学性质方面):Ⅱ能_____(填入编号,下同),而Ⅰ不能_____。
A.被酸性高锰酸钾溶液氧化 B.与溴水发生加成反应
C.与溴发生取代反应 D.与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6与H2加成,Ⅰ需_____mol,而Ⅱ需_______mol。
②今发现C6H6还可能有另一种如图所示的立体结构,该结构的二氯代物有___________种。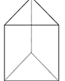
(2)已知萘的结构简式为 ,该结构简式不能解释萘的下列_______事实(填编号)。
,该结构简式不能解释萘的下列_______事实(填编号)。
A.萘不能使酸性高锰酸钾溶液褪色
B.萘能与H2发生加成反应
C.萘分子中所有原子在同一平面上
D.一溴代萘(C10H7Br)只有两种同分异构体
(6分)“立方烷”是合成的一种烃,其分子为正方体结构,其碳骨架结构如图A所示,则: 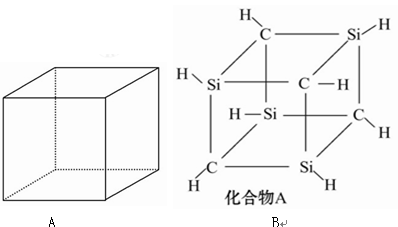
(1)写出立方烷的分子式__________。
(2)其二氯代物有____________种同分异构体。
(3)已知化合物A(C4Si4H8)与立方烷的分子结构相似,如图B所示,则C4Si4H8的二氯代物的同分异构体数目为________。
(10分)按分子结构决定性质的观点可推断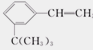 有如下性质:
有如下性质:
(1)苯环部分可发生______反应和__________反应;
(2)—CH=CH2部分可发生_______反应和_______反应;
(3)该有机物滴入溴水后生成产物的结构简式为_____。
(4分)(1)相对分子质量为70的烯烃的分子式为________;若该烯烃与足量的H2加成后能生成含3个甲基的烷烃,则该烯烃的可能的结构简式为________。