已知在容积固定的密闭容器中充入NH3和O2发生如下反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
(1)下列能说明该反应已经达到平衡状态的是 ;
A.容器中气体总质量不变
B.c(O2)不变
C.υ(O2)=1.25υ(NH3)
D.体系压强不变
E.相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
(2)向该容器中加入正催化剂,则反应速率 (选填“增大”、“减小”、“不变”,下同),降低容器的温度则反应速率 ,通入Ar,则反应速率 。
(3)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因是 。
A.反应体系温度先升高后降低,所以反应速率是先增大后减小
B.反应物浓度先升高后降低,所以反应速率先增大后减小
C.该反应为放热反应,在反应开始阶段,主要受体系温度升高的影响,反应速率增大;在反应后阶段,主要受浓度减小因素的影响,反应速率减慢
四种短周期非金属元素A、B、C、D,原子序数依次增大。A是原子半径最小的元素,B原子的最外层电子数是次外层电子数的两倍,D在地壳中含量最大。请回答:
(1)B元素的原子结构示意图是________。
(2)化合物A2D的电子式是________,结构式为________。
(3)B、D两元素形成化合物属 (“离子”或“共价”)化合物。
下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是,可用于制半导体材料的元素是_______。
(2)B的最高价氧化物对应的水化物与C的单质反应的化学方程式为,
(3)最高价氧化物对应的水化物中酸性最强的是;
(4)A分别与D、E、G、H形成的化合物中,最稳定的是;
(5)在B、C、D中,原子半径由大到小的顺序是。
(6分)比较下列性质(填“>”、 “<” 、“=”):
①径:NaF
②酸性:H2CO3HNO3
③碱性:NaOHMg(OH)2
④金属性:KRa
⑤稳定性:H2OH2S
⑥非金属性:CF
(1)有① 、
、 、
、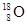 ②H2、D2、T2③石墨、金刚石 ④
②H2、D2、T2③石墨、金刚石 ④ 、
、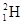 、
、 四组微粒或物质,互为同位素的是________(填编号,下同)。互为同素异形体的是________。
四组微粒或物质,互为同位素的是________(填编号,下同)。互为同素异形体的是________。
(2)在 H、
H、 H、
H、 H、40K、40Ca、14N、14C中共有_______种元素,_______种原子,中子数最多的是_______。
H、40K、40Ca、14N、14C中共有_______种元素,_______种原子,中子数最多的是_______。
X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)Y基态原子的电子排布式是________;Z所在周期中第一电离能最大的主族元素是_____。
(2)XY2-离子的立体构型是_______;R2+的水合离子中,提供孤电子对的原子是______。
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数之比是___________。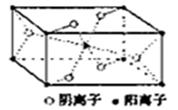
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是____________。