氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
⑴右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,
①请写出NO2和CO反应的热化学方程式
②当反应达到平衡时,升高温度,NO2的转化率___ ___(填“增大”“减小”“不变”)
③在反应体系中加入催化剂,反应速率增大,E1的变化是:E1_________(填“增大”“减小、”“不变”)。
⑵在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3 H2(g)
H2(g) 2NH3(g) △H < 0 ,其平衡常数K与温度T的关系如下表:
2NH3(g) △H < 0 ,其平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
①该反应的平衡常数表达式:K=
②试判断K1 K2(填写 “>”“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(10分)下列转化关系中,X、Y是生活中用处广泛的两种金属单质,A、B是氧化物,A呈红棕色,C、D、E是中学常见的三种化合物。分析转化关系回答问题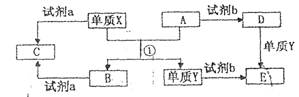
(1) 请写出反应①的化学方程式:______________
(2) 检验D溶液中问离子的方法是______________;
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式_______;
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制备一种髙效净水剂Y(OH)SO4,已知还原产物为N0,则该反应的化学方程式是_______;
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 m3,则阴极产物的质量为_______kg。
(8分)碘化钠是实验室中常用的分析试剂,工业上用铁屑还原法制备NaI的流程如下图: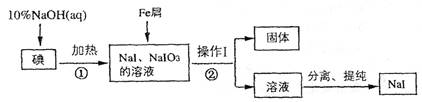
请回答下列问题:
(1) 判断反应①中碘是否反应完全的方法是_____________________
(2) 操作I的名称是_____________________;
(3) 反应①的离子方程式为_____________________
(4) 反应②中NaIO3被Fe单质还原为NaI,同时生成Fe(OH)3,该反应的化学方程式是______;
在该反应中若有99 g NaIO3被还原,则转移电子的物质的量为_______mol
(7分)咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:
(1)写出咖啡酸中两种含氧官能团的名称:_________
(2)根据咖啡酸的结构,列举三种咖啡酸可以发生的反应类型_______、_______、_______
(3)蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种醇A,则醇A的分子式为_______
(4)已知醇A含有苯环,且分子结构中无甲基,写出醇A在一定条件下与乙酸反应的化
学方程式_____________________
(1 5分)
有机物A~F有如下转化关系: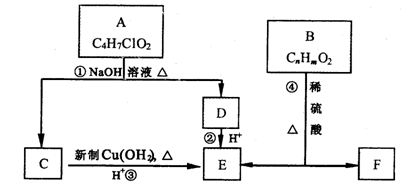
已知一个碳原子上连有两个羟基时不稳定,转化如下: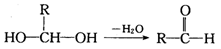
请回答:
(1)A的结构简式为:;④的反应类型
(2)C与新制Cu(OH)2的化学方程式为
(3)已知B的摩尔质量为162g/mol,完全燃烧的产物中n(CO2):n(H2O)=2:1,B的分子式为。
(4)F是生产高分子光阻剂的主要原料,特点如下:
①能发生加聚反应②含有苯环且苯环上一氯取代物只有两种③遇FeCl3显紫色
F与浓溴水反应的化学方程式
B与NaOH反应的化学方程式
(5)F的一种同分异构体G含苯环且能发生银镜反应。写出一种满足条件的G的结构简式
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满状态,且核外的未成对电子只有一个。回答下列问题:
(1)从电负性角度分析,X,Y,Z三种元素的非金属活泼性由强到弱的顺序为。
(2)X、Y分别与H形成的化学键的极性关系为X-HY-H(填“<”、“>”或“=”)。
(3)+l价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第____电离能。
(4)X的氢化物中X原子的杂化方式为sp2,则相对分子质量最小的分子式为____,
(5)W的价电子排布图为;下图____表示的是W晶体中微粒的堆积方式(填甲、乙或丙);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为____(写出含a的表达式,用NA表示阿伏伽德罗常数)。