已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要
原料合成一种具有果香味的物质E,其合成路线如下图所示。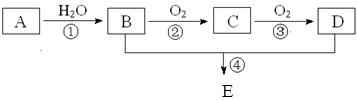
已知:醛可氧化生成羧酸。回答下列问题:
(1)写出下列物质的结构简式:A D E
(2)写出下列反应的化学方程式,并注明反应类型:
① 、
② 、
现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3)。在反应结束后的溶液中,逐滴加入2mol∙L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示。
(1)写出OA段反应的离子方程式:____________________________。
(2)B点时溶液中含有溶质的化学式为____________。
(3)a的数值为__________。
(4)原硝酸溶液中HNO3的物质的量为__________mol。
在某澄清溶液中,可能存在下列几种离子:H+、K+、Ba2+、SO42-、I-、CO32-。取该溶液进行下列实验:①用pH试纸检验,该溶液呈强酸性;②取200mL溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色;③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成。
(1)根据上述实验现象,推断原溶液中肯定存在的离子是_____________,肯定不存在的离子是_______,可能存在的离子是____________。
(2)若步骤②中消耗0.1molCl2,则溶液中与Cl2反应的离子的物质的量浓度为________________。
(3)写出实验③中生成白色沉淀的离子方程式:____________________。
磁性氧化铁(Fe3O4)可用于制造录音磁带和电讯器材,其溶于稀硝酸的化学方程式为:
3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O。
(1)Fe3O4晶体的颜色为______________。
(2)Fe(NO3)2在水溶液中的电离方程式为________________________。
(3)上述反应中,氧化剂是_____________(填化学式),被还原的氮元素与未被还原的氮元素的物质的量之比为_________,每生成2.24L(标准状况下)NO时,转移电子的物质的量为____________mol。
请按要求回答下列问题:
(1)非诺洛芬是治疗类风湿性关节炎的药物,其结构简式如图:
①非诺洛芬的含氧官能团名称为____________,②非诺洛芬能发生的有机反应类型有____________。
(2)写出下列反应的化学方程式:
①在加热、加压和催化剂条件下乙烯与水反应:______________________________。
②CH2=CHCOOCH2CH3的聚合反应:__________________________。
填空题
(1)碳原子最外电子层含有__________个电子,一个碳原子可以跟其他非金属原子形成__________共价键。
(2)在有机合成过程中,引入碳碳双键的三种方法是_____________、________________、_____________。
(3)根据官能团不同,单糖可分为_______________和________________________。
(4)核酸分为DNA和RNA,DNA的主要功能是________________;RNA的主要功能是____________。