实验室有一瓶标签受损的无色溶液,如下图所示。老师要求同学们进行探究:这瓶溶液到底是什么溶液?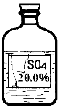
【提出猜想】 提示:这瓶无色溶液只能是下列四种溶液中的一种:
①硫酸镁溶液、②硫酸钠溶液、③硫酸铵溶液、④硫酸溶液
【查阅资料】 A:常温下,相关物质的溶解度如下:
| 物质 |
MgSO4 |
Na2SO4 |
(NH4)2SO4 |
H2SO4 |
| 溶解度 |
35.1g |
19.5g |
75.4g |
与水任意比互溶 |
B: (NH4)2SO4的水溶液显酸性
请回答:(1)该无色溶液一定含有的离子是 ;
【实验探究】(药品可自选)
(2)通过查阅资料(相关物质的溶解度表),小明同学认为猜想 (填序号)不成立,原因是 ;
(3)为确定其它几种猜想是否正确,小明同学设计实验继续进行探究:
| 实验操作 |
实验现象 |
实验结论 |
| ① 取该溶液少许于试管中,向其中滴加几滴 溶液 |
溶液中有白色沉淀生成 |
猜想①成立 |
| ② 用玻璃棒蘸取少许原溶液滴在pH试纸上,并跟比色卡对照 |
溶液pH小于7 |
猜想④成立 |
小雅同学认为小明实验操作②的结论不正确,她的理由是 ,
请你写出实验操作①反应的化学方程式 。
(答对下面(4)将奖励4分,但全卷总分不超过60分)
(4)请你设计实验方案,确认该溶液是硫酸铵溶液并完成实验报告:
| 实 验 操 作 |
实 验 现 象 |
实 验 结 论 |
| 取该溶液少许于试管中, |
|
猜想③成立,该反应的化学方程式为 |
"题23图"为某家长带小孩在下水道井盖小孔上点燃鞭炮发生爆炸的画面。现要探究某下水道的可燃性气体成分:
【猜想】(I)含可燃性气体
;
(II)含可燃性气体
;
(III)含可燃性气体
和
。
【收集气体】用大的可乐塑料瓶装满水,打开瓶盖用绳子吊入下水道中,用铁钩将矿泉水瓶倒转,使,将瓶提到井口迅速盖好瓶备用。
【进行实验】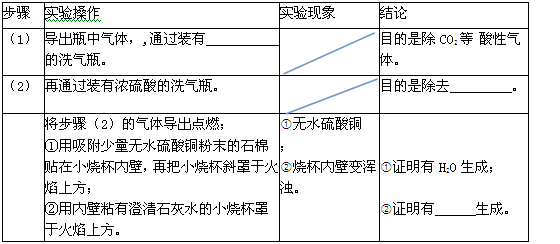
【作出判断】根据上述实验现象,甲同学认为猜想III正确;而乙同学认为甲的判断不严谨。
因为猜想也有相同的现象。如需进一步确认还应检验的存在,其方法是。
【拓展】若需要工人进入下水道清理淤泥,打开下水道井盖后应首先进行的操作是。
某研究小组利用下图所示装置探究碳的氧化物的性质(固定装置略)。已知碳酸镁加热发生类似碳酸钙的分解反应。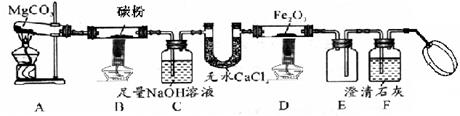
(1)装置
中发生的反应:(用化学方程式表示)。
(2)装置
的作用:,无水
的作用:。
(3)装置
中发生的反应:(用化学方程式表示)。
(4)图中装置
是安全瓶,能防倒吸,从实验安全考虑,本实验还应在装之间添加装置
。
某研究性学习小组为探究镁与水的反应,设计如下实验:
步骤1:将镁条用砂纸打磨至光亮,分成两等份。
步骤2:将一份光亮的镁条置于冷水中,几乎没有观察到任何现象。
步骤3:将另一份光亮的镁条置于热水中,观察到有气泡产生。
(1)将镁条用砂纸打磨至光亮的原因是。
(2)经百度可知,活泼金属与水反应生成对应的碱和氢气,如果金属活动性越强,生成的碱的碱性越强。某同学就向步骤3的烧杯中滴加酚酞试液,观察到镁条的表面有明显的红色出现。该反应的化学方程式:,反应类型是(基本反应类型)。
(3)步骤2和3对比可知,影响镁与水的反应速率的一个因素是。
(4)根据以上信息,若将金属钠加到硫酸铜溶液中,可能观察到的现象是。
有关
与
反应的探究
探究一:检验
固体样品露置空气中一段时间后的成分
【查阅资料】
溶液是碱性;
溶液、
溶液显中性、
难溶于水。
(1)检验样品是否变质。检验样品成分中是否含碳酸根的实验方法(操作、现象及结论):。
(2)检验样品是否完全变质。实验操作:取样品加水溶解,先加过量的(填编号,下同),再滴加。
| A. | 盐酸 |
| B. | 溶液 |
| C. | 溶液 |
| D. | 溶液 |
E.酚酞试液
探究二:用
溶液测定空气中酸性气体(
、
)的体积分数
【实验装置】如图8所示,向细玻璃管内注入少量水,形成一段水柱;经检查该装置气密性良好。已知细玻璃管单位长度的容积为0.1mL·cm-1。水柱的质量忽略不计。
【操作步骤】保持外界条件不变,完成以下操作:
①将40mL浓
溶液迅速倒入烧瓶内,立即塞紧橡皮塞,并在细玻璃管上标记水柱底部的位置
②观察并测量得出水柱缓慢向下移动的距离为2.0cm;
③实验结束后,根据①中的标记,测得该标记以下细玻璃管及烧瓶的总容积为340mL。
(3)检查图8装置气密性的操作方法:。
(4)仅根据本次测量数据,该气体样品中酸性气体的体积分数为(精确到0.00001)。
(5)在上述操作步骤②中,若装置温度略有升高,实验结果(填"偏大"、"不变"或"偏小")。
如下图所示为实验室中常见气体制备、净化、干燥、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器),某化学小组的同学欲利用其进行下列各探究实验。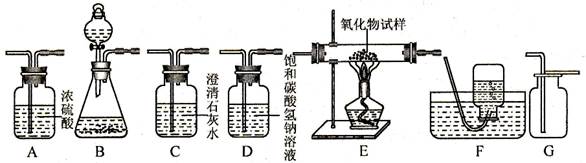
(1)以石灰石和稀盐酸为原料,在实验室中制备并收集干燥、纯净的二氧化碳气体。按照要求设计实验装置、连接仪器,并检验装置的气密性。
①所选仪器的连接顺序为(从左至右填写仪器序号字母)(提示:挥发出的少量
气体可用饱和碳酸氢钠溶液吸收)。
②用石灰石和稀盐酸制取二氧化碳的化学方程式为③若将二氧化碳气体通入酚酞试液中,试液显色。
(2)用一氧化碳气体(含少量水蒸气)测定某铁的氧化物(
)的元素组成比例,并验证反应中气体生成物的性质。所选仪器按A1 -----B-----C----- A2顺序连接(A1、A2为浓硫酸洗气瓶),并检验装置的气密性,所设计的实验装置中气体流向是从左向右。
①反应前大玻璃管中加入铁的粉末状氧化物(
)试样的质量为ag,实验结束后,继续通入一氧化碳气体,直至大玻璃管冷却。这时测量到E处大玻璃管中粉末状固体的质量减少了bg,试推算该铁的氧化物的化学式中x、y的比值:x/y=.(用含a和b的代数式表示)。(设所发生的反应均完全进行)
②将少量二氧化碳通入大量澄清石灰水中,出现白色浑浊,且溶液质量减小。试解释溶液质量减小的原因:.
③对于该实验方案设计还存在不完善之处,你的具体改进方案是