聚四氟乙烯的耐热性和化学稳定性超过其他塑料,被称为“塑料王”。其合成路线如下:
下列说法中,不正确的是( )
| A.“塑料王”不能使酸性高锰酸钾溶液褪色 |
| B.三氯甲烷(CHCl3)可以用甲烷与氯气的取代反应来制取 |
| C.四氟乙烯(CF2=CF2)中所有的原子都在同一平面上 |
| D.二氟一氯甲烷(CHClF2)中所有原子最外层都达到了8电子稳定结构 |
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指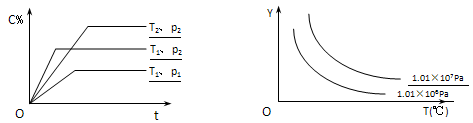
A.反应物A的百分含量 B.平衡混合气中物质B的百分含量
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量
在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g) 2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.30 mol·L-1时,则平衡时H2的浓度(mol·L-1)是
2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.30 mol·L-1时,则平衡时H2的浓度(mol·L-1)是
| A.0.16 | B.0.08 | C.0.06 | D.0.02 |
如图所示,a、b是两根石墨棒。下列叙述正确的是
| A.a是正极,发生还原反应 |
| B.b是阳极,发生氧化反应 |
| C.稀硫酸中硫酸根离子的物质的量不变 |
| D.往滤纸上滴加酚酞试液,a极附近颜色变红 |
在真空恒容密闭容器中盛有1 mol PCl5加热到200℃时发生的如下反应:
PCl5(气)  PCl3(气) +Cl2(气),反应达平衡后,PCl5所占体积分数为M%。若在同一温度和同一容器中,最初投入的是2 mol PCl5(气),反应达平衡时,PCl5所占体积分数为 N%。则M和N的正确关系是
PCl3(气) +Cl2(气),反应达平衡后,PCl5所占体积分数为M%。若在同一温度和同一容器中,最初投入的是2 mol PCl5(气),反应达平衡时,PCl5所占体积分数为 N%。则M和N的正确关系是
| A.M>N | B.M<N | C.M="N" | D.无法比较 |
对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率关系是:v(正)>v(逆) |