下面列出了几组物质,请将物质的合适序号填写在横线上。
① O2和O3 ② CH3CH3和CH3CH2CH2CH3 ③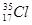 和
和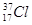
④ CH3CH(CH3)CH2CH3和C(CH3)4 
(1) 属于同位素的是: (2) 属于同素异形体的是:
(3) 属于同系物的是: (4) 属于同分异构体的是:
(5) 属于同一物质: 。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌,亚氯酸钠受热易分解。以氯酸钠(NaClO3)等为原料制备亚氯酸钠的工艺流程如下: 
(1)提高“反应1”反应速率的措施有、。(回答两点即可)
(2)“反应1” 的离子方程式是。
(3)“反应2”的氧化剂是,该反应的化学方程式为。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
A.准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
B.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用C mol·L-1Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL 。
(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为。
②该样品中NaClO2的质量分数为(用含m、c、V的代数式表示)。
钛是20世纪50年代发展起来的一种重要的结构金属,钛合金因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。
(1)与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有(填元素符号)。
(2)[Ti(OH)2(H2O)4]2+中的化学键有。
| A.σ键 | B.π键 | C.离子键 | D.配位键 |
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下图所示。
化合物甲的分子中采取sp2杂化方式的碳原子个数为,化合物乙中采取sp3杂化的原子的第一电离能由小到大的顺序为。
(4)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为,该晶体中Ti原子周围与它距离最近且相等的N原子的个数______。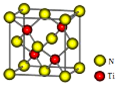
化工厂的设计是将实验室的研究成果转化为工业化生产的重要的基础工作。
(1)以硫铁矿为原料生产硫酸需经过、和三个主要生产阶段。
(2)侯氏制碱法是在索尔维制碱法的基础上创造出的一种新的制造纯碱的方法。具体工艺流程图如下:
①索尔维制碱法的原理是。(用化学方程式表示)
②侯氏制碱法与索尔维制碱法相比,优点是。
③侯氏制碱法可以循环使用的物质有。
(3)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和C12。海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是。
某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下:
回答下列问题:
(1)滤渣的成分为,操作①的名称为。
(2)上图溶液B中所发生反应的离子方程式为。
(3)实验要求向溶液B中通入过量的空气,证明通入空气过量的方法是。
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要、。
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。
①请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→_____→_____→_____→D(除D装置外,其它装置不能重复使用),最后D装置中所加药品为____________,其作用是___________________。
②点燃B处酒精灯之前必须进行的操作是____________________。
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是(填序号)
| A.Ba(NO3)2 | B.BaCl2 | C.Ba(OH)2 | D.溶有NH3的BaCl2溶液 |
③若将足量SO2气体通入0.2 mol·L-1的NaOH溶液,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为。
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作极(填“正”“负”“阴”或“阳”),其电极反应式为;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为,请判断T25℃(填“>”“<”“=”)。