已知有机物分子中的烯键可发生臭氧分解反应,例如:
R-CH=CH-CH2OH R-CH=O+O=CH-CH2OH
R-CH=O+O=CH-CH2OH
有机物A的分子式是C20H26O6,它可以在一定条件下发生缩聚反应合成一种感光性高分子B,B在微电子工业上用作光刻胶。
A的部分性质如下图所示:
试根据上述信息结合化学知识,回答:
(1)化合物(A)、(C)、(E)中,具有酯的结构的是 ;
(2)写出指定化合物的结构简式:C ;D ;E ;B 。
(3)写出反应类型:反应II ,反应III 。
把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+ O2(g)=====CO2(g);ΔH1<0 ①
途径Ⅱ先制成水煤气:
C(s)+H2O(g)=====CO(g)+H2(g);ΔH2>0 ②
再燃烧水煤气:
2CO(g)+O2(g)=====2CO2(g);ΔH3<0 ③
2H2(g)+O2(g)=====2H2O(g);ΔH4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量_________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______________。
已知H2 ( g ) + 1/2O2 ( g ) = 2H2O ( g ),反应过程中能量变化如下图:请回答下列问题: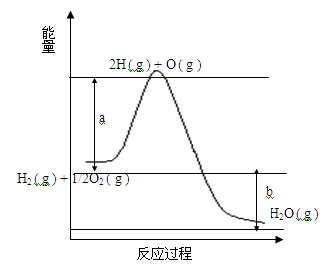
(1)图中a,b分别代表什么意义?a.;b.。
(2)该反应是反应(填“吸热”或“放热”),△H(填“< 0”或“> 0”)。
下表中是一些化学键键能的数据
| 化学键 |
Cl-Cl |
Br-Br |
I-I |
H-Cl |
H-Br |
H-I |
H-H |
| 键能(kJ/mol) |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
根据上述数据回答(1)~(3)题
(1)下列物质本身具有的能量最低的是
A.H2B.Cl2 C.Br2 D.I2
(2)X2 + H2 = 2HX(X代表卤族原子)的反应是反应(填“吸热”或“放热”)
(3)相同条件下,等物质的量的X2(卤素单质)分别与足量的氢气反应,放出或吸收的热量最多的是。
已知:(a)2H2(g)+O2(g)=2H2O(g) △H = -Q1
(b)2H2(g)+O2(g)=2H2O(1) △H = -Q2
(c)2CO(g)+O2(g)=2CO2(g) △H = -Q3
(1)Q1(填>、=、<)Q2,因为。
(2)CO和H2分别燃烧生成CO2和H2O(g),欲得到相同的热量,所需CO和H2的体积比是:。
红磷(P)和白磷(P4)均为磷的同素异形体。已知:
P4( 白s )+ 5O2( g )= P4O10( s ) △H =" -2983.2" kJ/mol
P(红 s )+ 5/4O2( g )= 1/4P4O10( s ) △H =" -738.5" kJ/mol
写出白磷转化为红磷的热化学方程式,由此可知,红磷比白磷。(填“稳定”或“不稳定”)