已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16,在一定条件下,各物质相互转化关系如下图所示。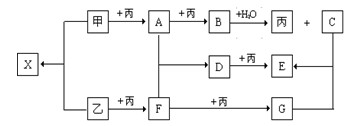
请按要求填空:
(1)丙的化学式是 ,G的化学式是 。
(2)写出有关变化的化学方程式
甲 + 乙: ;
D + 丙: 。
(3)B与X的水溶液反应生成C和乙的离子方程式是 。
(8分)已知X元素的原子K、L层电子数之和比L、M层电子数之和多1个电子。Y元素的原子最外层电子数比内层电子数少3个。Z元素原子核外有3个电子层,最外层有3个电子。回答下列问题:
(1)这三种元素的元素符号是:X________,Y________,Z________。
(2)用电子式表示X、Y形成化合物的过程为________。
(3)把X的单质放入水中,反应现象为___________,高温灼烧反应后的溶液时,火焰呈________色。
(4)当两个Y原子间形成化学键时要________热量。
(5)Y与Z形成化合物的化学式为________;实验测得,当此化合物在液态或固态时不导电,溶解于水时能导电,由此判断该化合物属于________化合物。
(10分)现有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4 g C与足量热水反应时,在标准状况下放出气体2.24 L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素名称:B________,C________,指出D在周期表中的位置_____________。
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为______________(用化学式表示)。
(3)写出淡黄色固体E的电子式________,其中含有的化学键为____________。
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出KA2与CO2发生反应的化学方程式__________________。K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它们的物质的量之比为________。
(14分)下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
⑩ |
(1)在这些元素中,化学性质最不活泼的是:________(填具体元素符号,下同),原子结构示意图为________。元素⑩名称为________在周期表中的位置________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是________,碱性最强的化合物的电子式是:________。
(3)用电子式表示元素④与⑥的化合物的形成过程:________________,该化合物属于________(填“共价”或“离子”)化合物。
(4)表示①与⑦的化合物的电子式________,该化合物是由________(填“极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是______________。
(6)元素③的氢化物的结构式为______;该氢化物常温下和元素⑦的单质反应的化学方程式为_______。
(6分)
(1) H、
H、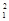 H、
H、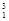 H互为________,16O2、18O3互为________。
H互为________,16O2、18O3互为________。
| A.同位素 | B.相同物质 |
| C.同素异形体 | D.同分异构体 |
(2)某元素的最高价氧化物分子式R2O5,已知R的气态氢化物中含氢8.82%,则R的相对原子量约为_______,R元素周期表中的位置为________________。
(3)铷和另一种碱金属形成的合金7.8 g与足量的水反应后,产生0.2 g氢气,则此合金中另一碱金属可能是:________________。(铷的相对原子量取85.5)
(4)质量相同的H2O和D2O与足量钠反应,放出的气体在标况下的体积之比为________。
煤粉中的氮元素在使用过程中的转化关系如下图所示: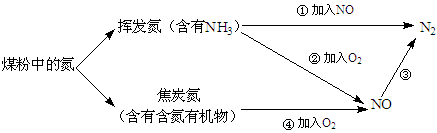
(1)②中NH3参与反应的化学方程式为。
(2)③中加入的物质可以是(填字母序号)。
a.空气b.CO c.KNO3d.NH3
(3)焦炭氮中有一种常见的含氮有机物吡啶(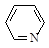 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更(填“强”或“弱”),从原子结构角度解释原因:。
),其分子中相邻的C和N原子相比,N原子吸引电子能力更(填“强”或“弱”),从原子结构角度解释原因:。
(4)已知:N2(g) + O2(g)===2NO(g) ΔH =" a" kJ·mol-1
N2(g) + 3H2(g)===2NH3(g) ΔH =" b" kJ·mol-1
2H2(g) + O2(g)===2H2O(l) ΔH =" c" kJ·mol-1
反应后恢复至常温常压,①中NH3参与反应的热化学方程式为。
(5)用间接电化学法除去NO的过程,如下图所示: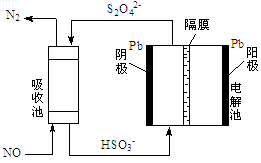
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:。
用离子方程式表示吸收池中除去NO的原理:。