紫外线吸收剂广泛用作有机高分子材料的抗老化剂及化妆品中的防晒剂,其系列产品有许多种类,其中第Ⅰ类产品为二苯甲酮( )及其衍生物,第Ⅱ类为苯甲酸苯酯(
)及其衍生物,第Ⅱ类为苯甲酸苯酯( )的衍生物,某紫外线吸收剂UV-0(属于第Ⅰ类产品)的合成路线如下:
)的衍生物,某紫外线吸收剂UV-0(属于第Ⅰ类产品)的合成路线如下:
已知:

请回答:
(1)A 的结构简式为 ,③的反应类型为 ;
(2)反应②的化学方程式为 ;
(3)产物UV-0的同分异构体中,符合第Ⅱ类产品结构的有机化合物共有 种;
(4)BAD也是一种紫外线吸收剂,属于第Ⅱ类产品,它的结构简式如下:
BAD中的含氧官能团为 (填名称),
1mol BAD最多能和含 mol NaOH的溶液进行反应;
(5)BAD 2
2 + M
+ M
M的核磁共振氢谱表明共含有 种不同环境的氢;写出含有同样种类的氢且比例关系相同的其中一种同分异构体的结构简式 。
烷烃A(C6H14)结构中共有四个甲基,能生成三种一氯代产物B、C、D。
B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下图所示(反应中生成的无机产物已略去),G分子中含有醛基(-CHO)。

请回答:
(1)写出结构简式:A;C;E。
(2)写出反应类型名称:B→F;F→E。
(3)写出F转化为G的化学方程式_________________
有以下一系列反应,终产物为乙二醛。
已知B的相对分子质量比A的大79,请回答:
(1)写出结构简式:A; E。
(2)写出B转化为C的化学方程式_________________
有机物的结构可用“键线式”简化表示
如:CH3-CH=CH-CH3可简写为 。某有机物X的键线式为
。某有机物X的键线式为 。
。
(1)有机物X的分子式为。
(2)X与足量的H2在一定条件下反应可得到有机物Y,则Y分子的一氯取代产物有种。
(3)X的同分异构体Z属于芳香烃,能使溴水褪色,Z的结构简式为,
该芳香烃Z在一定条件下可发生聚合反应,写出其反应的化学方程式。
(4)某醇W与X的相对分子质量相同,1 mol W与足量Na反应能产生标准状况下的氢气22.4 L,经测定W分子有如下特点:①一个碳原子最多连接一个官能团;②该分子不存在官能团位置异构现象。则W的结构简式为。
下表是A、B二种烃的有关信息;
| A |
B |
①能使含溴的四氯化碳溶液褪色;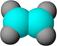 ②比例模型为: ②比例模型为:③能与水在一定条件下反应 |
①由C、H两种元素组成;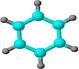 ②球棍模型为: ②球棍模型为: |
根据表中信息回答下列问题:
(1)A与含溴的四氯化碳溶液反应的生成物的名称叫做;
写出在一定条件下,A生成高分子化合物的化学反应方程式_______。
(2) A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=_________时,这类有机物开始出现同分异构体。
(3) B具有的性质是(填序号):
①无色无味液体、②有毒、③不溶于水、④密度比水大、
⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:。
汽油不仅是最重要的燃料,而且是重要的化工原料,它既可以裂解得到气态化工原料如乙烯等,还可以在催化剂催化下改变分子结构,由链烃变成芳香烃,如已烷变成苯,庚烷变成甲苯,这个变化叫异构化。请根据以汽油为原料的下列衍变关系,写出相应的化学方程式及所属反应类型。
(1) ;反应类型;
;反应类型;
(2);
(3);
(4);反应类型。