铝及其化合物在生产生活中具有重要的作用。
(1)铝在元素周期表中的位置是 。
(2)已知电负性的数值表示原子对电子吸引能力的相对大小。以下是几种原子的电负性数值:
| 元素 |
钠 |
镁 |
铝 |
硅 |
| 电负性 |
0.9 |
1.2 |
χ |
1.8 |
①铝的电负性χ的范围是 。
②电负性的数值与元素金属性的关系是 。
③下列实验能比较镁和铝的金属性强弱的是 。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al(s)+3O2(g)=2Al2O3(s) ΔH1=-3352 kJ/mol
Mn(s)+O2(g)=MnO2(s) ΔH2= -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是 。
(4)冶炼金属铝时,用石墨做电极电解熔融Al2O3。液态铝在(填“阴”或“阳”) 极得到,电解过程中,阳极石墨需要不断补充,结合电极反应说明其原因是 。
在某一容积为2 L的密闭容器中,A、B、C、D四种气体物质的量(n)随时间(t)的变化曲线如图所示: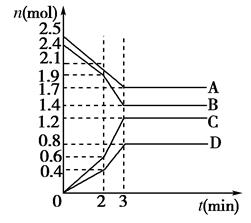
回答下列问题:
(1)该反应的化学方程式为___________________________________________;
(2)反应开始到2 min,用D的浓度变化表示的化学反应速率为________;
(3)在2 min时,图象发生改变的原因可能是_______________________(用字母表示)
A. 升高温度 B.加入稀有气体,增大压强
C.减少A的物质的量 D.加入催化剂
(4)下列叙述能说明上述反应达到平衡状态的是
A.混合气体的总质量不再变化 B.混合气体压强不再变化
C.v正(B)︰v逆(C)=5︰6D.消耗1mol A的同时生成1mol D
分别完全燃烧①1molCH4、②1molC2H4、③1molC6H6,生成的水相等的是; 需要的氧气最多的是。(填序号)
化学式为C8Hn的烷烃,m值等于;CnH22的烷烃,n值等于;相对分子质量为212的烷烃的分子式为。
茉莉花是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯: 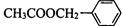 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
⑴写出反应①的化学方程式:。
⑵反应③的反应类型为。
⑶反应(填序号)原子的理论利用率为100%,符合绿色化学的要求。
⑷C的结构简式为,C通常有三种不同类别的芳香族同分异构体,试写出另两种不同类别的同分异构体的结构简式(各写一种)。
830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g);△H<0试回答下列问题:
CO2(g)+H2(g);△H<0试回答下列问题:
(1)若起始时c(CO)="2" mol•L-1,c(H2O)="3" mol•L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=.
(2)在相同温度下,若起始时c(CO)="1" mol•L-1,c(H2O)="2" mol•L-1,反应进行一段时间后,测得H2的浓度为0.5 mol•L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正)v(逆)(填“大于”“小于”或“等于”),你判断的依据是
。
(3)若降低温度,该反应的K值将(均填“增大”“减小”或“不变”)。