根据下面的反应路线及所给信息填空。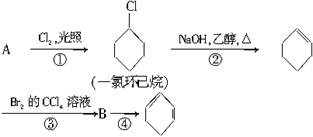
(1)A的结构简式是_________,名称是_________。
(2)①的反应类型是__________________。
③的反应类型是___________________________。
(3)反应④的化学方程式是___________________________________________________。
食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯的结构简式为 ,具有超强的阻隔性能,可作为保鲜食品的包装材料,它是由(写结构简式)发生加聚反应制得的。
,具有超强的阻隔性能,可作为保鲜食品的包装材料,它是由(写结构简式)发生加聚反应制得的。
(2)假酒中往往甲醇含量超标,若从乙醇和甲醇的混合液中分离出甲醇,下列方法正确的是(填序号)。
①过滤②分液③蒸馏④结晶
(3)毒奶粉中常加有害物质三聚氰胺(结构简式如图所示),已知1 g三聚氰胺晶体完全燃烧生成N2、CO2和液态水时,放出a kJ热量,1 mol H2O(g)转化为1 mol H2O(l)时放出44 kJ热量,则在101 kPa 120℃三聚氰胺晶体完全燃烧时生成N2、CO2和水蒸气的热化学方程式为:
(4)劣质植物油中的亚油酸(C18H32O2)含量很低,下列有关亚油酸的叙述正确的是(填序号)。
①亚油酸分子中的含氧官能团为羧基
②亚油酸甘油酯完全硬化时与消耗H2的物质的量之比为1∶2
③亚油酸可发生氧化反应、加成反应、取代反应
④可用酸性KMnO4溶液检验亚油酸甘油酯的皂化反应是否完全
(5)在淀粉中加入吊白块制得粉丝有毒,吊白块又称雕白粉,化学名称为二水合次硫酸氢钠甲醛(化学式为:NaHSO2·CH2O·2H2O,相对分子质量为:154),有漂白作用。已知某种含吊白块的粉丝(不考虑吊白块的损失)1 g中含硫0.32 %,则每千克这种粉丝中含吊白块的质量为g。
(16分)某研究小组取足量形状、质量均相同的铝片,分别与浓度均为6 mol•L-1的等体积的盐酸、氢氧化钠溶液充分反应后,取出剩余的铝片洗净、干燥、称量。
(1)上述反应剩余铝片的质量,前者________后者(填“大于”或“小于”或“等于”)。
(2)观察铝片与盐酸反应后的溶液较浑浊,且试管底部有少量黑色固体。
查资料已知:
①铝与盐酸反应,因反应过快而变成粉末分散到溶液中,形成黑色固体
②电解法冶炼铝所用的原料氧化铝是从铝土矿中提取的,氧化铝中往往还含有微量的氧化铁和二氧化硅杂质。写出在电解池中生成的铝与杂质二氧化硅反应的化学方程式: ________。
(3)为探究(2)中黑色固体的成分,提出合理假设。
假设1:黑色固体是Al和Fe
假设2:黑色固体是Al和Si
假设3:黑色固体是Al和_______________
(4)设计实验方案,基于假设3进行实验,验证黑色固体含有Al之外的其它成分。
限选实验试剂:蒸馏水、6mol·L-1H2SO4溶液、6mol·L-1NaOH溶液、6mol·L-1氨水、0.01mol·L-1KMnO4溶液、新制氯水、20%KSCN溶液。
| 实验步骤 |
预期实验现象和结论 |
| 步骤1:将反应所得浊液过滤、洗涤,取少量固体于试管中,加入足量的6mol·L-1 H2SO4溶液,充分振荡,静置。 |
___________________________________, 证明黑色固体含有Si |
| 步骤2: |
(5)已知硅与NaOH溶液反应与铝相似。取m1g黑色固体加足量NaOH溶液充分溶解,
滤去不溶物(不考虑可溶物的损失),配成250mL溶液,取出25.00mL溶液,按下列操作进行实验: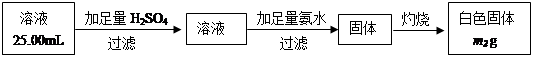
在上述操作中,需要用到的玻璃定量仪器有________________________________;
计算黑色固体中Al的质量分数为__________________(相对原子质量:Al-27 Fe-56 H-1 O-16)。
钯(Pd)的性质与铂相似。工业上从废催化剂(主要成分是钯和活性炭,还含有少量铁、锌)中回收钯,采用如下流程: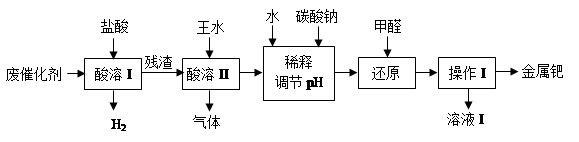
请回答下列问题:
(1)酸溶I的目的是__________________________________。
(2)①酸溶Ⅱ时残渣与王水在加热条件发生的主要反应是:
3Pd +12HCl + 2HNO3  3H2PdCl4 + 2NO↑+ 4H2O
3H2PdCl4 + 2NO↑+ 4H2O
写出催化剂中另一主要成分与浓硝酸反应的化学方程式:_________________。
②酸溶Ⅱ需控制温度不宜过高,除了控制一定反应速率外,其原因可能还有
_____________________________。
③若用足量的烧碱吸收气体,请写出吸收后溶液中含有的溶质的化学式:NaOH、NaNO2、___________、___________。
(3)使用甲醛还原钯的化合物时,溶液须保持碱性,否则会造成甲醛的额外损耗,原因是_______________________________________。
(4)操作I的名称是_______________,溶液I可能含有的有机离子为________________。
(5)有人提出,在进行酸溶前最好先将废催化剂在700℃下进行灼烧,同时不断通入空气,
其目的是______________________________________________________。
请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)我国储氢纳米碳管研究已取得重大进展。用电弧法合成的碳纳米管中常伴有大量碳
纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
___C + ___K2Cr2O7 + _______=" ___" CO2↑ + ___K2SO4 + ___Cr2(SO4)3 +___H2O
请完成并配平上述化学方程式。
(2)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g)  CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1
①下列措施中有利于增大该反应的反应速率的是____________。
| A.使用高效催化剂 | B.降低反应温度 |
| C.增大体系压强 | D.不断将CH3OH从反应混合物中分离出来 |
②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2)/n(CO)的起始组成比的关系如右图所示。已知容器体积1L,起始时CO的物质的量均为1mol。据此判断在上述三种温度中,曲线Z对应的温度是__________;利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K =_______________________。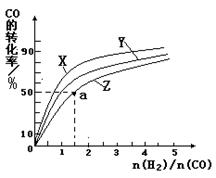
③已知: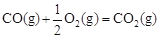 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1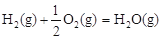 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气的热化学方程式为_________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其溶度积常数Ksp=
c(Ca2+)·c(CO32—)=2.8×10−9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10 -5 mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为________________________。
异戊二烯(即2-甲基-1,3丁二烯)是橡胶工业的重要原料。工业上有多种合成方法,其中两种如下: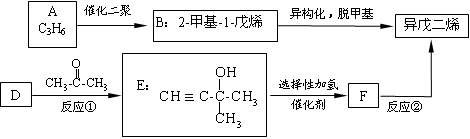
根据题意回答下列问题:
(1)A的结构简式为______________。已知D可作为生产高分子导电材料的原料,则D
的名称是______________。
(2)反应①的反应类型是____________________。
反应②的化学方程式为_____________________________________________。
(3)下列说法正确的是_____________(填字母序号)。
A.1mol E完全燃烧耗6.5 mol氧气
B.A与B、E与F分别互为同系物
C.1mol异戊二烯与1mol Br2发生加成反应,产物不只一种
D.聚乙烯、聚异戊二烯均可以使溴的四氯化碳溶液褪色
(4)烯烃复分解反应可表示如下(炔烃也能发生此类反应):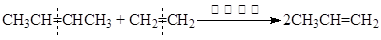
写出CH2=CH—CH2—CH2—CH2—CH2—CH=CH2发生复分解反应生成六元环的化
学方程式:___________________________________________________________。
(5)与异戊二烯相差一个“CH2”原子团,且结构中只有一个甲基的同系物除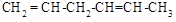 、
、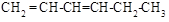 、
、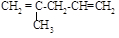 外,
外,
还有________________、_______________(填结构简式,已知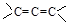 不稳定)。
不稳定)。