(1)元素的第一电离能:(填">"或"<")。
(2)基态的核外电子排布式为。
(3)硅烷()的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是。

(4)硼砂是含结晶水的四硼酸钠,其阴离子(含三种元素)的球棍模型如图所示
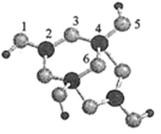
①在中,硼原子轨道的杂化类型有;配位键存在于原子之间(填原子的数字标号);=(填数字)。
②硼砂晶体由、和构成,它们之间的作用力有(填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。
请回答下列问题:
(1)S、N、O的的第一电离能由大到小的顺序为。
(2)SO2、CO、NO2、O3常温下均为气体,固态时均属于晶体。
(3)随着人们生活质量的提高,室内的环境安全和食品安全越来越为人们所关注。甲醛(HCHO)是室内主要空气污染物之一(其沸点是–19.5 ℃),甲醇(CH3OH)是“假酒”中的主要有害物质(其沸点是64.65 ℃)。甲醛分子中C原子采取杂化轨道方式。甲醇的沸点明显高于甲醛的主要原因是:
__________。
(4)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O,该反应可用于测定空气中CO含量。
①写出铜原子的基态电子排布式。
②CuCl的晶体结构如下图甲所示,与同一个Cl-距离最近的相邻Cu+有个。
③Cu(CO)Cl·H2O的结构如上图乙所示,图中标示出8个是共价键,其中个是配位键,
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如下:
|

(1)在废渣溶解操作时,应选用__________溶解(填字母)。
| A.氨水 | B.氢氧化钠 | C.盐酸 | D.硫酸 |
(2)物质A是一种氧化剂,工业上最好选用(供选择使用的有:空气、Cl2、MnO2),其理由是 。
(3)根据下图有关数据,你认为工业上氧化操作时应控制的条件是:
。
(4)“结晶”反应的化学方程式为
。
(5)简述检验“滤液”中含有NH4+的实验方法:
。
A、D、E、X、Y是原子序数依次增大的短周期主族元素。其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用。
(1)Y的离子结构示意图为。
(2)钠、A和X三种元素组成的化合物,其所含的化学键类型有。
(3)甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键。常温下甲是一种无色液体。
①甲是一种二元弱碱,写出其 一级电离方程式:。
一级电离方程式:。
②甲在碱性溶液中能够将CuO还原为Cu2O,已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为:。
(4)处理含DX、YX2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质Y。已知反应生成1 g Y固体单质时放出8.4 k J热量,此反应的热化学方程式为。
J热量,此反应的热化学方程式为。
(5)将0.050 mol YX2(g)和0.030 mol X2(g)放入容积为1 L的密闭容器中,反应:
X2(g) +2YX 2(g) 2YX3(g)在一定条件下达到平衡。
2YX3(g)在一定条件下达到平衡。
①若其他条件不变,增大体系的压强,平衡常数K(填“增大”、“减小”或“不变”)。
②平衡时测得c(X2)=0.010 mol·Lˉ1。该条件下反应的平衡常数K=,YX2的平衡转化率为。
碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l);△H1= —1214kJ/mol
②2CO(g)+O2(g)=2CO2(g);△H2= —566kJ/mol
则反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H=。
(2)①将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其正极电极反应式是:。
②某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
③若将 所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为。
所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为。
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
650 |
2 |
4 |
1.6 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
3 |
| 3 |
900 |
a |
b |
c |
1 |
①实验1中,以v(H2)表示的平均反应速率为。
②该反应的正反应为(填“吸”或“放”)热反应。
(4)将2.4g碳(碳的相对原子质量为12)在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中的溶质的化学式是;溶液中所含离子的物质的量浓度由大到小的顺序为:。
化合物B是生活中一种常见的有机物,制取E和F的转化关系如下图所示。已知C能使溴水褪色,F有果香味。
(1)指出反应类型:①;③。
(2)C的分子式为:。
(3)写出②转化的化学方程式:②。
(4)F有多种同分异构体,写出其中两种的结构简式、。