已知X、Y和Z三种元素的原子序数之和等于48。X是有机物主要组成元素。X的一种1∶1型气态氢化物分子中既有σ键又有π键。Z是金属元素,Z的核电荷数小于28,且次外层有2个未成对电子。
(1)X在该氢化物中以 方式杂化。X和Y形成的化合物的熔点应该 (填“高于”或“低于”)X氢化物的熔点。
(2)Y在周期表中位于 ;Z4+的核外电子排布式为 。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看作一种含氧酸盐)。经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。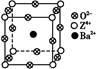
①制备M的化学反应方程式是 (Z用元素符号表示)。
②在M晶体中,Ba2+的氧配位数(Ba2+周围等距且最近的O2-的数目)为 。
③晶体M密度的计算式为ρ= (Z相对原子质量为48)。
【原创】Ⅰ.(6分)在某盐甲的溶液中加入NaOH溶液,加热,会产生能使酚酞试液变红的气体乙;若在盐甲溶液中加入铜片和稀盐酸,则会产生无色气体,该气体遇空气变红棕色。
(1)盐甲中阳离子的电子式 。
(2)气体乙使酚酞试液变红原因是 。(用电离方程式表示)
(3)写出盐甲与铜片和稀盐酸反应的离子的方程式 。
Ⅱ.(12分)某种无机矿物的主要成分M含有五种元素,且含有结晶水。为了探究M的化学式,某化学兴趣小组做了下列实验:
(1)M的化学式为 。反应中生成红褐色沉淀的离子方程式为 。
(2)写出溶液1与过量CO2反应的离子方程式 ;实验中要将红褐色沉淀灼烧后再称量的原因是 。
(3)将白色沉淀1充分灼烧可得固体X。固体X与氯气混合加热可能发生氧化还原反应,写出一个可能的化学反应方程 ,并设计实验方案验证该反应的固体的产物 。
【命题立意】与近几年高考试题相比,预测无机综合题难度可能会有所加大,基于此考虑,本题的第Ⅱ小题综合性较强,难度较大,意在对学生获取和处理信息的能力、分析和解决化学问题的能力和实验探究能力进行综合考查。定性与定量分析的巧妙设计、化学反应的推测、实验设计与评价是本题的主要亮点。
【改编】【2014嘉兴二模卷改编】(15分)汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染。
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g)△H1
4NO(g)+CO2(g)+2H2O(g)△H1
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g)△H2
2N2(g)+CO2(g)+2H2O(g)△H2
③CH4(g) +2NO2(g) N2(g) +CO2(g) +2H2O(g) △H3
N2(g) +CO2(g) +2H2O(g) △H3
则△H1、△H2、△H3三者关系式为 。
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
| 投料比[n(NO2) : n(CH4)] |
400 K |
500 K |
600 K |
| 1 |
60% |
43% |
28% |
| 2 |
45% |
33% |
20% |
①写出该反应平衡常数的表达式K= 。
②若温度不变,提高[n(NO2) : n(CH4)]投料比,则K将 。(填“增大”、“减小”或“不变”)
③400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的5L容器中,10分钟达到平衡,则NO2的化学反应速率为 。
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图如图1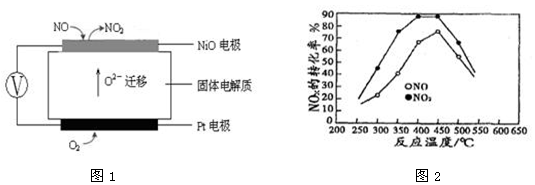
①NiO电极上NO发生的电极反应式 。
②收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中n(NO)︰n(NO2)= 。
(4)在容积相同的两个密闭容器内(装有等量的某种催化剂)先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生②③两个反应:并在t秒时测定其中NOx转化率,绘得图象如图2所示:
①从图中可以得出的结论是 。
结论一:相同温度下NO转化效率比NO2的低。
结论二:在250℃—450℃时,NOx转化率随温度升高而增大,450℃—600℃时NOx转化率随温度升高而减小。
结论二的原因是 。
②在上述NO2和CH4反应中,提高NO2转化率的措施有_________。(填编号)
A.改用高效催化剂
B.降低温度
C.分离出H2O(g)
D.增大压强
E.增加原催化剂的表面积
F.减小投料比[n(NO2) : n(CH4)]
【原创】(10分)脱羧反应形成新的C-C键为有机合成提供了一条新的途径,例如: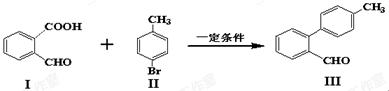
(1)化合物I含有的官能团名称是______________。
(2) 与
与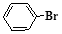 也能发生脱羧反应,有机产物的结构简式为 。
也能发生脱羧反应,有机产物的结构简式为 。
(3)化合物III与新制氢氧化铜反应的化学方程式为 。
(4)下列有关化合物Ⅲ的说法正确的是 。
| A.化合物无Ⅲ分子式为C14H15O |
| B.1mol化合物Ⅲ最多可以与6mol H2反应 |
| C.化合物无Ⅲ分子中的所有碳原子一定处于同一平面 |
| D.化合物Ⅲ既可以发生氧化反应和还原反应,也可以发生加成反应和取代反应 |
(5)写出符合下列条件的化合物的同分异构体 。
①化合物I的最简单同系物
②苯环上有两种不同类型的氢原子
(12分)为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1:2:3。
④用红外光谱仪处理该化合物,得到如图三所示图谱。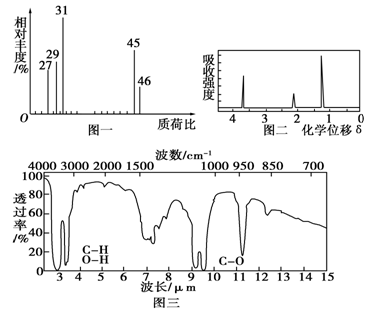
试回答下列问题:
(1)有机物A的相对分子质量是__________。
(2)有机物A的实验式是____________________。
(3)能否根据A的实验式确定A的分子式______(填“能”或“不能”),若能,则A的分子式是__________(若不能,则此空不填)。
(4)写出有机物A的结构简式______________。
【改编】卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷常作为有机溶剂,其中分子结构为正四面体的是________。
(2)聚氯乙烯是生活中常用的塑料。工业生产聚氯乙烯的一种工艺路线如下:
反应①的化学方程式为__________________________;
反应②的反应类型为________。
写出由氯乙烯制备聚氯乙烯的方程式_______________________。