[化学一有机化学基础]
对二甲苯(英文名称,缩写为)是化学工业的重要原料。
(1)写出PX的结构简式
(2)PX 可发生的反应有
(3)增塑剂(DEHP)存在如下图所示的转化关系,其中 是PX的一种同分异构体。

① 的苯环上存在2 种不同化学环境的氢原子,则的结构简式是
② 分子所含官能团是
③ 分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是
(4)是的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;.遇溶液显示特征颜色;.能与碳酸氢钠溶液反应。
写出与溶液反应的化学方程式
如下图所示,烧杯中都盛有稀硫酸。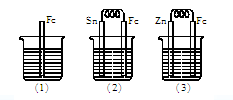
(1)中反应的离子方程式为。
(2)中的电极反应:Fe:,Sn:。
(3)中被腐蚀的金属是,其电极反应式为。
比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是。
(7分,每空1分)如图所示,已知A元素的最低化合价为-3价,它的最高价氧化物含氧56.21%,原子核内中子数比质子数多1,试用相应元素符号或化学式回答: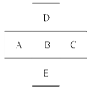
(1)写出它们的元素符号:
A__________,B__________,C___________,D__________。
(2)A、B、C的原子半径由小到大的顺序是________________________________。
(3)A、B、C的最高价氧化物对应水化物的酸性由强到弱的顺序是;D、B两元素的气态氢化物稳定性大小顺序是.
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 。(填写相应的元素符号)D元素的最高价氧化物的水化物是。
(2)写出A、B的化合物与E反应的化学方程式:
。
(3)A、B两元素形成的化合物属(填“离子”或“共价”)化合物,画出此物质的电子式。用电子式表示出C和D组成的化合物的形成过程:。
(4)写出D元素的最高价氧化物的水化物和A发生反应的化学方程式:
。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________________________________;
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________(选填“是”或“否”),混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________________;
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是________________________________;
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________ mol·L-1,
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)=________mol·L-1,c(OH-)-c(HA)=________mol·L-1
(共16分)Ⅰ.(1)硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请简要说明原因______________________,如何才能用热水配制出澄清的较浓的CuSO4溶液____________________;
(2)稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的化学反应______________________________________________
Ⅱ.某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.将溶液转移至250 mL容量瓶中,加水至刻度线; |
| B.用移液管(或碱式滴定管)量取25.00 mL烧碱溶液于锥形瓶中并加几滴甲基橙作指示剂; |
| C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为m mol•L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度数为V1 mL; |
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点消耗酸的体积V2 mL。
回答下列问题:
(1)正确的操作步骤的顺序是(填写字母)
________→________→________→________→________;
(2)终点到达的现象是________________________;
(3)若酸式滴定管没有用标准H2SO4润洗,对测定结果影响________,滴定前仰视读数滴定后俯视读数对测定结果影响________ ;(填“偏高”、“偏低”或“无影响”,其他操作均正确)。
(4)该烧碱的百分含量是________。