二氧化硫是形成酸雨的罪魁祸首之一。化学小组的同学想对二氧化硫进行研究,依据化学方程式Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后。取一定量的锌粉与98%的浓硫酸恰好完全反应。
ZnSO4+SO2↑+2H2O计算后。取一定量的锌粉与98%的浓硫酸恰好完全反应。
提出问题:对于制得的气体,有同学认为可能含有杂质。
猜想与假设:化学小组制得的SO2中混有的杂质主要是H2。产生这一结果的主要原因是 (用化学方程式和必要的文字说明)。
查阅资料:(1)CO2能与水、 反应,SO2与CO2一样,也能。
(2)H2与CO一样,能将金属氧化物冶炼成金属。
(3)CaSO3难溶于水
实验验证:为证实相关分析,化学小组的同学设计了下图所示装置进行实验。 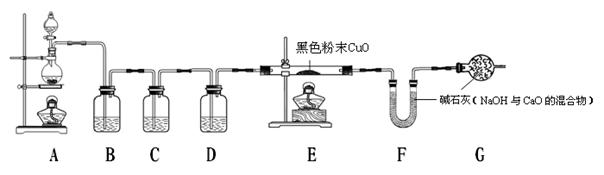
(1)B装置的作用是 。
(2)混合气体中含有氢气,则E装置中观察到的现象是 ,反应的化学方程式为 。
实验反思:小芳认为,利用上述装置可以测定混合气体中二氧化硫和氢气的质量比,要达到这一目的,实验小组必须测定下列数据中的 (填字母)。
| A.参加反应的锌的质量 | B.装置B的质量增量 |
| C.氧化铜的质量 | D.装置 F的质量增量 |
通过观察和实验等方法获取证据是科学探究的重要环节。
(1)向少量 沉淀中加入稀盐酸,观察到______,可判断发生了反应。
(2)向 溶液中通入 ,观察到______,可判断发生了反应。
(3)向氢氧化钙溶液中滴加稀盐酸,无明显现象。两位同学欲获取反应发生的证据。
①甲同学向滴有酚酞溶液的氢氧化钙溶液中,逐滴滴加稀盐酸至足量,溶液由红色变成无色,证明溶液中______,可判断 与 发生了反应。
②乙同学将氢氧化钙溶液与稀盐酸混合,然后检验了混合液中含有 和 ,他据此认为 与 发生了反应,且生成了 。你认为乙同学是否找到了反应发生的证据?请说出你的观点并阐述理由:______。
(4)如图a所示,向 稀溶液中缓缓通入 气体,测定该过程中溶液导电能力的变化,实验结果如图b.(溶液体积、温度的变化可忽略)

①分析A→B段变化,其他条件相同,导电能力: ______ 。(填“>”“<”或“=”)
②分析B→C段变化,溶液的导电能力除了与离子种类有关,还与______有关。
[科学探究]
耕地盐碱化影响粮食安全,盐碱地综合治理与利用可促进农业高质量发展,兴趣小组开展了与土壤盐碱化相关的探究活动。
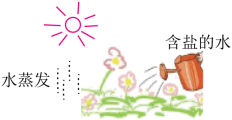
(1)成因:由农业灌溉或化肥施用引起的土壤盐碱化如图所示,当进入土壤中盐的量超出植物的吸收能力时,随水分蒸发,__________导致土壤盐碱化。
(2)检测:配制土壤样品浸出液、用_______测定、若 、则浸出液显__________性。
(3)探究:某地土壤碱化可能由 、 中的一种两种引起。教师提供模拟盐碱化壤样品浸出液。
[查阅资料] 易溶于水; 为白色固体,难溶于水; 为白色固体,难溶于水和盐酸。
[提出问题]样品中的是什么?
[作出猜想]猜想1:
猜想2:_________
猜想3: 和
[实验探究]
(4)取少量出分别加管A、B中
|
实验序号 |
操作 |
现象 |
结论 |
|
1 |
向A中滴加少量 溶液 |
产生白色沉淀 |
含 |
|
2 |
向B中滴加过量稀盐酸 |
_______ |
含 |
[分析评价]
(5)有同学认为实验1不够严谨,理由是______________(用化学方程式解释)
[补充实验]
(6)
|
实验序号 |
操作 |
现象 |
结论 |
|
3 |
向实验2反应后的溶液中滴加少量 溶液 |
_______ |
猜想3成立 |
(7)交流:应对土壤盐碱化的合理措施有___________(多选,填字母)
| A. |
合理施肥 |
B. |
引海水灌溉 |
C. |
用熟石灰改良 |
D. |
种植耐盐碱作物 |
救治新冠患者需要氧气,制氧机制氧是一种途径。某品牌制氧机中有一包白色颗粒和一包黑色粉末,白色颗粒成分为过碳酸钠(化学式为 ,它是过氧化氢与碳酸钠的化合物,遇水后放出氧气)。某小组设计实验探究其制氧原理。
【探究一】
(1)分别取等质量的白色颗粒和等体积的水加入a、b两支试管,再向b试管中加入黑色粉末。观察到a试管仅有少量气泡,b试管有大量气泡。
①黑色粉末起 作用。
②欲使a试管产生气泡加快,可加入 (填序号)。
A. 溶液
B. 溶液
C.
【探究二】
(2)根据元素守恒,上述反应后溶液中溶质的成分可能为:
①只含 ②只含 ③ 和 的混合物……
甲、乙两同学仅针对前三种可能性,分别设计实验1和实验2进行验证。
|
序号 |
操作和现象 |
实验结论 |
|
实验1 |
取b试管上层清液滴加过量稀盐酸,产生能使澄清石灰水变浑浊的气体 |
只含 |
|
实验2 |
第一步:取b试管上层清液滴加过量 溶液,产生白色沉淀并过滤 第二步:在滤液中滴加酚酞,溶液 (填现象) |
只含 |
【反思评价】
(3)丙同学认为实验1的结论不严谨,理由是 。
【得出结论】
(4)结合实验现象,该制氧机的制氧原理有两步反应,写出第二步的化学方程式:
① ;② 。
【延伸拓展】
(5)制氧机制氧选择过碳酸钠而不选择双氧水的根本原因是 (填序号)。
A.产物无污染
B.制取成本更低
C.运输储存更方便

在学习二氧化碳性质时,小舟进行如图探究:

【制取气体】用石灰石和稀盐酸作为原料制取二氧化碳气体,收集时要得到平稳的气流,应选择图甲中的 (填字母)作为发生装置。
【探究性质】用图乙装置完成二氧化碳性质的探究后,小舟还想用该装置来验证氧气的密度大于空气密度的性质。若他将氧气倒入装有两支带火星的蜡烛的烧杯中(如图丙),预期观察到的现象是 。
小丽和小科在做“金属与酸反应”的实验时,他们分别将镁条投入盛有稀盐酸的试管中,小丽加入少量镁条,而小科加入了足量镁条。一段时间后,小科的试管底部“意外”地出现了灰白色固体。为探究该固体是什么物质,他们开展了如下探究:
【提出问题】足量镁和稀盐酸反应生成的灰白色固体是什么?
【查阅资料】氢氧化镁和碱式氯化镁[ ]都难溶于水,但都能与稀硝酸反应,后者能生成 和 。
【建立假设】假设1:未溶解完的氯化镁;假设2:氢氧化镁;假设3:碱式氯化镁;……
【进行实验】将灰白色固体过滤、充分洗涤后进行如下实验:
|
序号 |
实验操作 |
实验现象 |
实验结论 |
|
实验一 |
取灰白色固体于试管中,加入足量蒸馏水,充分振荡 |
固体不溶解 |
假设1 |
|
实验二 |
取灰白色固体于试管中,加入足量稀硝酸,充分振荡 |
固体溶解 |
假设2不成立 |
|
往上述溶液中滴加硝酸银溶液 |
|
【评价交流】小丽认为该灰白色固体一定是碱式氯化镁。小科认为上述探究还不足以说明该固体就是碱式氯化镁,其理由是 。
【继续探究】……