氢化钙(
)固体是一种储氢材料,是登山运动员常用的能源提供剂。
【阅读资料】
①碱石灰是氧化钙和氢氧化钠的混合物。
②钙遇水立即发生剧烈反应生成氢氧化钙和氢气。
③氢化钙要密封保存,遇水反应生成氢氧化钙和氢气。
【氢化钙的制备】
氢化钙通常用氢气与钙加热制得。某化学兴趣小组设计的制取装置如图10所示(固定装置省略)。

图10
回答下列问题:
(1)装置A中制取氢气的化学方程式为。
(2)装置B的作用是。
(3)装置C中制取氢化钙的化学方程式为。
(4)若不改变温度,整套装置气密性的检查方法是。
【产品的定量测定】
通过上述方法制得的氢化钙样品中常混有未完全反应的钙(其余可能的杂质忽略不计)。样品纯度的测定步骤如下:
①检查装置气密性,装入药品,按图11(固定装置省略)所示连接仪器。
②调整水准管高度,使量气装置两边的液面保持同一水平。读取液面所在的刻度数据为10.0 mL。
③将Y形管慢慢倾斜,直到A端的水全部与B端的样品混合。
④反应结束,冷却至室温,再次读取液面所在刻度数据为110.0 mL。
回答下列问题:
(5)如何判断样品与水完全反应:。
(6)反应生成氢气的体积为mL。
(7)已知该实验条件下,氢气的密度为0.09 mg/mL。样品中氢化钙的纯度为。(结果精确到0.1%)
小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡。为了解其反应过程,他与学习小组的同学进行了如下探究。
【探究一】小组同学根据所学的化学知识设计并进行了如图所示的实验。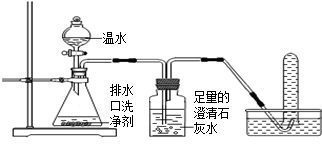
A B C
实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺。由此同学们得出结论:生成的两种气体分别是:(填化学式)。B中有关反应的化学方程式是。
【探究二】
(1)实验过程:
教师提供了一瓶过碳酸钠(Na2CO4),小组同学进行了如下实验探究: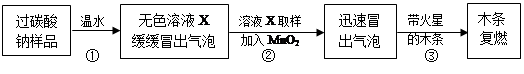
(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设: 根据以上实验现象,X溶液中一定存在的溶质是;还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种。
(4)查找资料:
资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;
氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3 + CaCl2 ═ CaCO3↓ + 2NaCl。
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀;碳酸氢钠、碳酸钠与足量的酸反应产物相同。
(5)实验过程:小组同学对溶液X中的溶质进行了如下实验。请将下列实验方案填写完整。
| 实验操作 |
主要实验现象 |
结论 |
| ① |
证明溶液中有Na2CO3 |
|
| ② |
证明溶液中无NaHCO3 |
|
| ③ |
证明溶液中无NaOH |
(6)实验反思:根据资料,NaHCO3溶液能与石灰水反应生成白色沉淀。于是,同学们猜想:碳酸氢钠与氢氧化钠是否可以发生(写方程式)这样的反应?于是,同学们进行了新的探究实验。
根据下图中所示装置回答下列问题: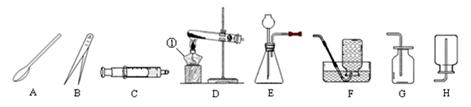
(1)写出图中标示的仪器名称:①。
(2)实验室用KMnO4制取O2,应选用的发生装置为(填字母序号,下同),收集装置可选用(写一种即可),取用KMnO4固体时,应选用的仪器,写出该反应的化学方程式。
(3)注射器C可用于检查装置E的气密性,步骤如下:
①向锥形瓶中加入少量水至没过长颈漏斗下端处。②将注射器C连接到装置E的导管口处。
③缓慢拉动注射器C的活塞,观察到,表示装置E的气密性良好。
(4)实验室用装置E制取CO2时,如用注射器C替换长颈漏斗,优点是
。
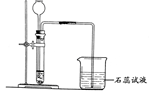
某化学兴趣小组利用下列装置进行O2、CO2、H2的实验室制法和有关性质的研究。回答下列问题: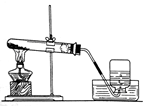

AB C
(1)甲同学用KMnO4固体制取O2,选用上图中的__装置(填序号),该反应的化学方程式是。
(2)乙同学用浓盐酸和大理石在B装置中反应,制取CO2并检验其有关性质,观察到烧杯中紫色石蕊试液变红。对这一变化的合理解释是_________________(填序号)。
A.产生的CO2直接使石蕊试液变红
B.产生的CO2与水反应生成H2CO3使石蕊试液变红
C.挥发出的氯化氢溶于水使石蕊试液变红
(3)丙同学用C装置制取了一瓶H2,写出用C装置制取H2的药品_______________________。
实验小组对铁的锈蚀按下表探究。室温时,将包有样品的滤纸包固定在橡胶塞上,迅速塞紧,装置如图。观察到量筒内水沿导管慢慢进入广口瓶(净容积为146 mL)。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如表.
| 序号 |
样品 |
量筒起始读数 /mL |
量筒最终读数 /mL |
所需时间 /min |
| ① |
1 g铁粉、0.2 g碳和10滴水 |
100 |
70 |
约120 |
| ② |
l g铁粉、0.2 g碳、10滴水和少量NaCl |
100 |
70 |
约70 |
| ③ |

(1)实验①和②说明NaCl可以(填“加快”或“减慢”)铁锈蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是(填“放热”或“吸热”)过程。
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是。
(4)实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成。
某学习小组同学在协助老师整理化学试剂时,发现一瓶标签残缺的无色液体,如图所示。他们对此瓶无色液体是什么产生了兴趣,于是就进行了如下探究。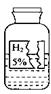
[猜想与假设]
小明同学的猜想是:水;小红同学的猜想是:硫酸;小玲同学的猜想是:过氧化氢溶液。学习小组同学对标签进行了仔细观察、分析,他们一致认为小明的猜想不合理,其理由是
。
[活动与探究]
根据以上讨论,小组同学对合理的猜想进行如下实验探究。请你帮助完成下列实验报告:
| 猜想 |
操作步骤 |
实验现象 |
结论和化学方程式 |
| 小红的猜想 |
取少量该溶液加入试管中, 再滴加适量的BaCl2溶液。 |
小红的猜想不成立。 |
|
| 小玲的猜想 |
小玲的猜想成立, 反应的化学方程式为: |