今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生
②第二份加足量NaOH溶液加热后,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
试回答下列问题
(1)由实验②可知溶液中含有的离子为 ,在100mL溶液中该离子的物质的量浓度为
(2)由实验③可以判断中溶液中含有的离子为
(3)由上述实验信息判断下列说法中正确的是
| A.K+一定存在 | B.100mL溶液中含0.01mol CO32- |
| C.Cl-可能存在 | D.Ba2+一定不存在,Mg2+可能存在 |
工业制硫酸生产流程如下图: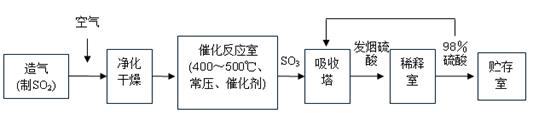
已知:在450℃,常压下,2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。请回答:
2SO3(g),ΔH=-196 kJ·mol-1。请回答:
(1)在催化反应室,下列措施中有利于提高SO2平衡转化率的有;
A.升高温度 B.减少压强 C.不断补充空气 D.及时分离出SO3
(2)在生产中,为提高催化剂效率可采取的措施为;
A.净化气体 B.控制温度在400~500℃
C.增大催化剂与反应气体的接触面积 D.不断补充空气
(3)在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”、“>”或“=”)196kJ。
(4)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下,现有100L原料气参加反应,达到平衡时,气体的总体积变为97.2L,则SO2的转化率为。
如下表所示为自然界中的多种铜矿石的主要成分:
| 矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
| 主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 (填化学式);
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程包含反应:
2Cu2O+Cu2S 6Cu+SO2↑,则该反应的氧化剂与还原剂的物质的量之比是 ;
6Cu+SO2↑,则该反应的氧化剂与还原剂的物质的量之比是 ;
(3)火法溶炼工艺生产铜的尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中一种酸和一种盐的名称或化学式 、 。
(4)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
| A |
铜绿的主成分是碱式碱酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ对;有 |
| B |
铜表易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ对;有 |
| C |
铁比铜活泼 |
铆在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ对;有 |
| D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ对;无 |
元素A、B、C、D均为短周期元素,请根据表中信息回答下列问题。
| 元素 |
A |
B |
C |
D |
| 性质 结构 信息 |
单质制成的高压灯,发出的黄光透雾力强、射程远。 |
工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构。 |
单质常温、常压下是气体,原子的M层有一个未成对的p电子。 |
+3价阳离子的核外电子排布与氖原子相同。 |
(1)上表中与A属于同一周期的元素是(填元素符号),D离子的核外电子排布式为;
(2)A和B形成的化合物晶体类型为;C单质与氢氧化钠溶液反应的离子方程式为;
(3)对元素B的相关描述正确的是。
a.B元素的最高正价可能为+6 b.常温、常压下B单质难溶于水
c.B单质分子中含有18个电子 d.在一定条件下B单质能与镁条反应
乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2 g金属钠充分反应,则标准状况下生成气体的体积是L
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8 g,碱石灰增重13.2 g。则氧气的物质的量是mol,燃烧产物的平均摩尔质量是g/mol。
现有镁条、铝粉、铜片、氧化铝、氧化铁、氯酸钾及其它常用的实验用品和仪器,根据现有药品,请你设计简单实验验证铝、铁金属单质的还原性强弱。依据你设计的实验方案,回答下列问题:
(1)实验原理:(用化学方程式表示);实验中所需的化学仪器为。
(2)引发实验的操作方法为:。
(3)实验探究:取少量反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,(填能或否)说明固体混合物中无Fe2O3,并说明理由(理由用离子方程式说明)。