X、Y、Z、W均为短周期元素,它们在周期表中的位置如下图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( ) 
| A.原子半径:W>Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.气态氢化物的稳定性:X>Y>Z>W |
| D.四种元素的单质中,Z单质的熔沸点最高 |
已知a g气体X2中含有b个X原子,那么c g该气体在0℃、1.01×105 Pa条件下的体积是(NA表示阿伏加德罗常数的值)
将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+ 28HNO3=9Fe(NO3)x+ NO↑+14H2O 。下列判断合理的是
| A.Fe(NO3)x中的x为2 |
| B.反应中每生成0.2 mol 还原产物,就有0.6 mol 电子转移 |
| C.稀HNO3在反应中只作氧化剂 |
| D.磁性氧化铁中的铁元素全部被氧化 |
在5mL 0.05 mo1/L的某金属氯化物溶液中,滴加0.1 mo1/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为:
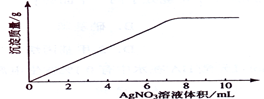

| A.+1 | B.+2 | C.+3 | D.+4 |
某溶液中含有HCO3-、SO32-、CO32-、CH3COO-等4种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假定溶液体积无变化)
| A.HCO3- | B.SO32- | C.CO32- | D.CH3COO- |
在烧瓶中充满干燥标准状况下HCl与N2的混合气,已知其相对分子质量为34.8,进行喷泉实验后所得溶液的物质的量浓度为
| A.0.022mol·L—1 | B.0.045 mol·L—1 | C.0.8 mol·L—1 | D.0.1 mol·L—1 |