下列有关化学反应原理的应用叙述中,正确的是
| A.用明矾净水是因为Al3+水解生成的Al(OH)3胶粒具有很强的吸附性 |
| B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| C.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 |
| D.工业合成氨使用催化剂是为了加快反应速率和提高氨的产量 |
以下命题,违背化学变化规律的是()
| A.石墨制成金刚石 |
| B.煤加氢变成人造石油 |
| C.水变成汽油 |
| D.干冰转化成原子晶体 |
有专家指出,如果利用太阳能使燃烧产物如CO2、H2O、N2等重新组合,使之能够实现循环利用,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。在此构想的物质循环图中太阳能最后转化为()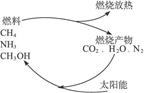
| A.化学能 | B.热能 | C.生物能 | D.电能 |
聚丙烯酸酯类涂料是目前市场上流行的墙面涂料之一,它具有弹性好、不易老化、耐擦洗、色泽亮丽等优点。如下是聚丙烯酸酯的类别,它属于()
①无机化合物 ②有机化合物 ③高分子化合物 ④离子化合物 ⑤共价化合物
| A.①③④ | B.①③⑤ | C.②③⑤ | D.②③④ |
下列说法中正确的是()
| A.凡能发生银镜反应的有机物一定是醛 |
| B.在氧气中燃烧时只生成CO2和H2O的物质一定是烃 |
| C.乙酸是有机弱酸,所以它的酸性比碳酸弱 |
| D.在酯化反应中,羧酸脱去羧基中的羟基,醇脱去羟基中的氢原子而生成酯 |
下列物质为2005年新合成的一种有机物:
形成该有机物使用的单体有()
| A.2种 | B.3种 | C.4种 | D.5种 |