了解一些用药常识,有利于自我保健。现有下列药物:碳酸镁、青霉素、阿司匹林、氢氧化铝。
(1)其中属于解热镇痛的药物是__________。
(2)青霉素的作用是__________。
(3)药片常用淀粉作为黏合剂,淀粉水解的最终产物是__________。
(4)碳酸镁可治疗胃酸过多的原理是__________(用离子方程式表示)。
某烃A 0.2 mol 在氧气中完全燃烧后,生成CO2和H2O各1.2 mol。试回答:
(1)烃A的分子式为_____________。
(2)若取一定量的烃A完全燃烧后,生成CO2和H2O各3 mol,则有________g烃A参加了反应,燃烧时消耗标准状况下的氧气___________L。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为__________________。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为_______________________________________。
下列各化合物中,属于同系物的是(填入编号)▲,属于同分异构体的是(填入编号)▲。
下表是元素周期表的一部分,回答下列有关问题: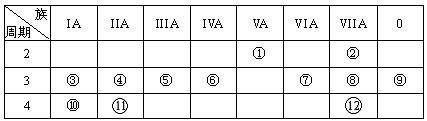
(1)写出下列元素符号:① ______,⑦ __ __。
(2)在①~(12)元素中,金属性最强的元素是_____,非金属性最强的元素是______,最不活泼的元素是____。(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)第三周期中原子半径最大的元素是,跟它与⑦元素可以形成(填离子或共价)化合物,用电子式表示其形成过程如下:。
(5)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,请用电子式表示其化合物:.
有A、B、C、D、E五种微粒,其组成均有氢元素,且电子总数为10个,A是双原子的阴离子,它们之间能发生下列变化:
(1)A+B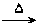 C+D↑ (2)C+C
C+D↑ (2)C+C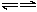 A+E (3)D+E
A+E (3)D+E B+C
B+C
由此可知它们的化学式分别为:
A,B,
C,D,E。
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B,C,D,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
。
(3)写出A、B两元素相互反应的化学方程式:
。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
。