在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g) E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L—1。下列说法正确的是
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L—1。下列说法正确的是
| A.4min时,M的转化率为80% |
| B.4min时,用M表示这段时间内的反应速率为0.8mol·L—1·min—1 |
| C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小 |
| D.2min时,M的物质的量浓度为0.6mol·L—1 |
共价键、离子键和范德华力是粒子之间的三种作用力。下列晶体①Na2O2②SiO2
③石墨④金刚石⑤NaCl⑥白磷中,含有两种作用力的是:
| A.①②③ | B.①③⑥ | C.②④⑥ | D.①②③⑥ |
下列性质符合分子晶体的是:
| A.熔点1070℃,易溶于水,水溶液能导电 |
| B.熔点是10.31℃,液体不导电,水溶液能导电 |
| C.熔点97.81℃,质软,能导电,密度是0.97g/cm3 |
| D.熔点781℃,熔化时能导电,水溶液也能导电 |
.下列说法不正确的是:
| A.若把HF分子写成H2F分子,违反了共价键的饱和性 |
B.若把碳的轨道式写成 则违反了泡里不相容原理 则违反了泡里不相容原理 |
| C.若把Be的基态电子排布式写成1s22s12p1 则违反了能量最低原理 |
D.若把氧的轨道式写成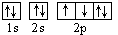 则违反了洪特规则 则违反了洪特规则 |
美国Lawrece Liermore国家实验室(LINL)成功地在高压下将 转化为具有类似
转化为具有类似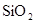 结构的原子晶体,下列关于
结构的原子晶体,下列关于 的原子晶体说法,正确的是:
的原子晶体说法,正确的是:
A. 的原子晶体和分子晶体互为同分异构体 的原子晶体和分子晶体互为同分异构体 |
B.在一定条件下, 原子晶体转化为 原子晶体转化为 分子晶体是物理变化 分子晶体是物理变化 |
C. 的原子晶体和 的原子晶体和 分子晶体具有相同的物理性质和化学性质 分子晶体具有相同的物理性质和化学性质 |
D.在 的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合 的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合 |
. 168O、188O、O2-、O2、O3是:
| A.氧元素的五种不同微粒 | B.五种氧元素 |
| C.氧的五种同素异形体 | D.氧的五种同位素 |