设NA为阿伏加德罗常数的值,下列有关叙述正确的是
| A.1 mol羟基所含的电子总数为10NA |
| B.标准状况下,1L正戊烷完全燃烧所生成的CO2分子数为5NA/22.4 |
| C.4.2g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
| D.1 mol碳正离子(CH3+)所含的电子总数为8NA |
下列有关实验装置(装置中略去支撑仪器)进行的相应实验,能达到实验目的的是
| A.用图1装置制取并收集干燥纯净的NH3 |
| B.用图2所示装置可除去NO2中的NO |
| C.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液 |
| D.用图4装置制备Fe(OH)2并能较长时间观察其颜色 |
下列有关物质的性质及其应用说法正确的是
| A.碳酸钠能与盐酸反应,医疗上常用碳酸钠治疗胃酸过多 |
| B.铁比铜活泼,在海轮外壳上安装铜块以减缓船体腐蚀 |
| C.漂白粉在空气中不稳定,可以用来漂白纸张 |
| D.二氧化硫具有较强的还原性,故常用作葡萄酒的抗氧化剂 |
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
| A.使酚酞变红色的溶液:Na+、Ba2+、I-、Cl- |
| B.使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42- |
| C.含有0.1 mol·L-1 Fe3+的溶液:Na+、K+、SCN-、NO3- |
| D.由水电离产生的c(H+)=10-12mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
下列化学用语或模型图示正确的是
A.核内有8个中子的碳原子: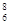 C C |
B.Mg2+的结构示意图: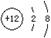 |
C.Na2O2的电子式: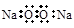 |
D.聚丙烯的结构简式: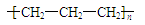 |
化学与人类生活、能源开发、资源利用等密切相关。下列说法正确的是
| A.塑料奶瓶比玻璃奶瓶更有利于健康,且更加经久耐用 |
| B.“绿色化学”的核心是利用化学原理,解决和治理环境污染问题 |
| C.硅燃烧放出的热量多,且燃烧产物对环境污染程度低,可做“未来石油” |
| D.秸秆的综合利用,如发酵制沼气、生产乙醇等,工艺复杂,还不如一把火烧光还田来得方便 |