某温度时,在2L密闭容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。由图中的数据分析,该反应的化学方程式为 ;反应从开始至2min末,Z的平均反应速率为 
A、B都是芳香族化合物,1molA水解得到1molB和1mol醋酸。A、B的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O。且B分子中碳和氢元素总的质量分数为65.2%。A溶液具有酸性,不能使FeCl3溶液显色。
(1)A、B的相对分子质量之差为。
(2)1个B分子中应该有个氧原子。
(3)A中所含的官能团有:。
(4)B可能的结构简式是。
(5)1molB物质分别与足量的碳酸氢钠溶液、氢氧化钠溶液反应理论上消耗二者的物质的量之比是。
电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
① 电解池中X极上的电极反应式为。在X极附近观察到的现象是。
② Y电极上的电极反应式为,检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极的材料是,电极反应式是。
② Y电极的材料是,电极反应式是。
(说明:杂质发生的电极反应不必写出)
实验室进行实验①制乙烯 ②制溴苯 ③石油分馏 ④银镜反应 ⑤制乙酸乙酯
(1)不需要加热的有;
(2)需要水浴的有;
(3)需要加碎瓷片的有;
(4)反应中必须加入浓 的有。
的有。
某烯烃,经与氢气加成反应可得到结构简式为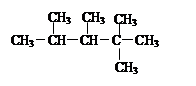 的烷烃,则此烯烃可能的结构简式是:、、。
的烷烃,则此烯烃可能的结构简式是:、、。
硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置)。仅用此装置和表中提供的部分物质完成相关实验。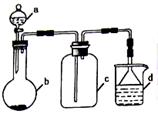
| 序号 |
a中的物质 |
b中的物质 |
c中收集的气体 |
d中的物质 |
| 甲 |
浓硫酸 |
Na2SO3 |
① |
② |
| 乙 |
浓硝酸 |
Cu |
③ |
NaOH |
| 丙 |
浓盐酸 |
MnO2 |
Cl2 |
NaOH溶液 |
按要求回答下列问题:
(1)表格中①②③三种物质分别是__________、__________、________(填化学式)。
(2)实验乙中生成气体③的离子反应方程式为________________________;某同学认为将浓硝酸改为稀硝酸,即可以利用本套装置制取NO气体,该同学的设计________(填“正确”或“不正确”)。
(3)已知实验丙中生成氯气的化学方程式为4HCl(浓)+MnO2  MnCl2+ Cl2↑+2H2O,在该反应中每生成22.4L(标准状况下)氯气,被氧化HCl的物质的量为__________,转移电子的物质的量为________;d装置中发生反应的离子方程式为_________________。实验室还可以用高锰酸钾和浓盐酸反应制取氯气,完成并配平该反应的离子方程式:
MnCl2+ Cl2↑+2H2O,在该反应中每生成22.4L(标准状况下)氯气,被氧化HCl的物质的量为__________,转移电子的物质的量为________;d装置中发生反应的离子方程式为_________________。实验室还可以用高锰酸钾和浓盐酸反应制取氯气,完成并配平该反应的离子方程式:
____ MnO4-+ ____ H+ + ____ Cl- ____ Mn2+ + ____ Cl2↑+ ____ _________
____ Mn2+ + ____ Cl2↑+ ____ _________