1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。下表给出的是第三周期的七种元素和第四周期的钾元素的电负性的值。下列说法不正确的是( )
| 元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
| 电负性 |
0.9 |
1.2 |
1.5 |
? |
2.1 |
2.3 |
3.0 |
0.8 |
A 钙元素的电负性的取值范围在0.8与1.2之间
B.硫化钠的电子式为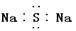
C 硅元素的电负性的取值范围在1.5与2.1之间
D Al与S形成的化学键可能为共价键
下列叙述中正确选项的个数是
①含有共价键的化合物不一定是共价化合物;
②原子间以极性键结合而成的分子必定是极性分子;
③只含有共价键的物质一定是共价化合物;
④离子晶体中可能含有共价键,但一定含有金属元素;
⑤不含非极性共价键的分子晶体一定是共价化合物;
⑥熔化不导电的化合物一定是共价化合物;
⑦分子晶体中一定含有共价键;
⑧离子晶体都是化合物;
⑨冰熔化时水分子中共价键发生断裂。
| A.2个 | B.3个 | C.4个 | D.5个 |
关于氢键,下列说法正确的是
| A.每一个水分子内含有两个氢键 |
| B.DNA双螺旋的两个螺旋链不是通过氢键相互结合的 |
| C.冰和水中都存在氢键 |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
共价键、离子键和范德华力都是微粒间的作用力,下列物质:①Na2O2;②SiO2;③石墨;④金刚石;⑤CaCl2;⑥白磷,含有上述结合力中的两种的组合是
| A.①③⑤⑥ | B.①③⑥ | C.②④⑥ | D.①②③⑥ |
下列说法正确的是(NA为阿伏加德罗常数)
| A.124 g P4含有P—P键的个数为4NA |
| B.12 g石墨中含有C—C键的个数为3NA |
| C.12 g金刚石中含有C—C键的个数为2NA |
| D.60gSiO2中含Si—O键的个数为2NA |
目前,科学界拟合成一种“双重结构”的球形分子,即把足球烯C60的分子容纳在Si60分子中,外面的硅原子与里面的碳原子以其价键结合,下列叙述错误的是
| A.该晶体属分子晶体 | B.该分子内原子间都以极性共价键相连接 |
| C.该物质是一种新化合物 | D.该物质的相对分子质量为2400 |