(16分)(1)反应A(g)+B(s) C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
①升温____________;②增大压强____________;③增大容器容积____________;
④加入A____________; ⑤加入B____________; ⑥加正催化剂____________。
(2)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为___________________________________________。
(3)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6),丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC CH(g)+H2(g) △H1="+156.6" kJ·mol-1
CH(g)+H2(g) △H1="+156.6" kJ·mol-1
CH3CH CH2(g)= CH4(g)+HC
CH2(g)= CH4(g)+HC CH(g ) △H2="+32.4" kJ·mol-1
CH(g ) △H2="+32.4" kJ·mol-1
则相同条件下,反应C3H8(g)=CH3CH CH2(g)+H2(g) 的△H= kJ·mol-1。
CH2(g)+H2(g) 的△H= kJ·mol-1。
(4)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
| 化学键 |
C—H |
C—F |
H—F |
F—F |
| 键能 |
414 |
489 |
565 |
158 |
根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)﹦CF4(g)+4HF(g) △H=______________________
在下列各变化中,反应①为常温下的反应,A 、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。
、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。
回答下列问题:
(1)A、G的化学式分别为___ ___、______。
(2)A和E反应的离子方程式为______。
(3)写出反应①的化学方程式______________________________。
(4 )在反应②中,每生成2.24 L气体G(标准状况)时,消耗F ____g。
)在反应②中,每生成2.24 L气体G(标准状况)时,消耗F ____g。
有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,火焰呈黄色,透过蓝色的钴玻璃观察,未见紫色火焰。
由上述现象推断:
该混合物中一定含有、、;一定不含有、、;可能含有。
用20.0g烧碱配制成500mL溶液,其物质的量浓度为mol·L-1;从中取出10mL,其物质的量浓度为mol·L-1。若将这10mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为mol·L-1。
科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3h):
| T/K |
303 |
313 |
323 |
353 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(l)====2NH3(g)+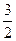 O2(g)ΔH
O2(g)ΔH =+765.2kJ·mol-1
=+765.2kJ·mol-1
回答下列问题:
(1)右图是上述反应在无催化剂情况下反应过程中体系能量变化示意图,请在图中画出在有催化剂情况下反应过程中体系能量变化示意图。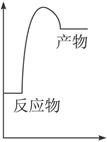
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议:。
(3)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为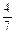 。计算
。计算
①该条件下N2的平衡转化率是;
②该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数为
N2(g)+3H2(g)的平衡常数为 。
。
③若温度不变,减小容器体积,则平衡向---------------------------移动,c(NH3)将--------------------
c(N2)将----------------------(填增大、减小或不变)
有一化学反应2A B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空: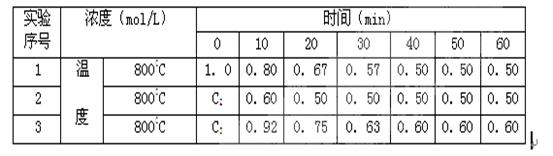
(1)在实验1,反应在0至20分钟时间内A的平均速率为mol/(L·min)。
(2)在实验2,A的初始浓度C2=mol/L,可推测实验2中隐含的条件是。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3v1(填>、=、<=,)800℃时,反应平衡常数=,且C3=mol/L,可推测实验3中隐含的条件是。
(4)800℃时,反应B+D  2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为mol/L, B的转化率=。
2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为mol/L, B的转化率=。