(6分)今有10种物质:①石墨、②硫酸钡、③盐酸、④氨气、⑤石灰水、⑥氢氧化镁、⑦熔融NaCl、⑧蒸馏水、⑨二氧化硫、⑩固体氧化钠。其中:(填序号)
(1)属于电解质的是 。
(2)属于非电解质的是 。
(3)能导电的是 。
煤是一种常用的燃料。由于煤燃烧产生的废气中含有SO2、NO2和NO等多种有害气体和烟尘会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧,造成环境污染的主要原因之一是形成硝酸型酸雨。
①写出有关物质转化为硝酸的化学方程式______________________________________。
②以下是对硝酸型酸雨的评价,其中正确的是________(用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生生态系统;
b.对电线、铁轨、桥梁、房屋等均会造成严重损害;
c.破坏臭氧层;
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥。
(2)下图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图,试写出在废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式____________________________。
(3)脱硫以后,在废气中含量明显增加的不良气体是(写物质名称)________,它对环境的负面影响是______________________________________________________________________。
(4)检验脱硫后废气中是否含有SO2的简单方法是__________________________________。
瑞士化学家米勒因合成DDT于1948年获得诺贝尔医学奖。在第二次世界大战中的1944年,美国在意大利的许多士兵因使用DDT来扑灭传染斑疹伤寒流行病人身上的虱子而避免丧生。联合国世界卫生组织曾评价说:“单独从疟疾病者,DDT可能拯救了5000万生命。”但进一步的观察和研究表明,DDT是一种难降解的有毒化合物,进入人体内可引起慢性中毒。我国已于1983年停止生产和使用。
(1)杀虫剂“1605”本身对人畜毒性远强于DDT,但DDT已被禁用,而“1605”尚未禁用,这是因为________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
由结构分析知:“1605”在使用过程中,不能与________物质混合使用,否则会因________________________________________________________________________。
(2)DDT可以用电石为原料经以下途径而制得: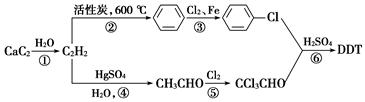
①写出④⑤⑥步反应的化学方程式。
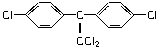
②DDT有毒性,国际上已禁止使用,因为它在动物体内转化为一种使动物生长失调的物质(结构如下面所示结构式)。在实验室也可实现这种转化,表示这种转化的化学方程式为________________________________________________________________________
________________________________________________________________________。
请阅读下列短文:
在含羰基 的化合物中,羰基碳原子与两个烃基直接相连时,叫做酮。当两个烃基都是脂肪烃基时,叫脂肪酮,如甲基酮
的化合物中,羰基碳原子与两个烃基直接相连时,叫做酮。当两个烃基都是脂肪烃基时,叫脂肪酮,如甲基酮 ;都是芳香烃基时,叫芳香酮;如两个烃基是相互连接的闭合环状结构时,叫环酮,如环己酮
;都是芳香烃基时,叫芳香酮;如两个烃基是相互连接的闭合环状结构时,叫环酮,如环己酮 。
。
(1)有一种名贵香料——灵猫香酮 属于(填字母代号)
属于(填字母代号)
a.脂肪酮 b.脂环酮 c.芳香酮
(2)樟脑也是一种重要的酮 ,它不仅是一种家用杀虫剂,且是香料、塑料、医药工业的重要原料,它的分子式为________。
,它不仅是一种家用杀虫剂,且是香料、塑料、医药工业的重要原料,它的分子式为________。
反应条件是影响化学反应类型的重要因素。在光照下,1 mol苯和3 mol Cl2反应,生成“六六六”,化学方程式为
________________________________________________________________________,
反应类型为__________________。而在FeCl3的作用下,1 mol苯与1 mol Cl2反应,有氯化氢生成,化学方程式为________________________________,反应类型为_______________。
按照化学组成和结构,常用的杀虫剂主要包括:第一代合成农药________________,第二代合成农药________________,第三代合成农药________________等。