下列实验操作错误的是
| A.用药匙取用少量Na2SO4固体 |
| B.用胶头滴管滴加少量NaC1溶液 |
C.加热盛有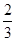 体积K2 SO4溶液的试管 体积K2 SO4溶液的试管 |
| D.用10 mL量筒量取8 mL1.0mol·L-1 NaOH溶液 |
下列说法中,错误的是
| A.化学反应必然伴随能量变化 |
| B.需加热才能发生的化学反应一定是吸热反应 |
| C.化学反应中的能量变化主要是由化学键的断裂和形成引起的 |
| D.反应物与生成物总能量的相对大小决定反应是吸热或放热 |
科学家从化肥厂生产的(NH4)2SO4中检出化学式为N4H4(SO4)2的物质,该物质的晶体中含有SO42-和N4H44+两种离子,当N4H44+遇到碱性溶液时,会生成N4分子。下列说法正确的是
| A.14N、N4与N2互为同位素 |
B.N4H4(SO4)2的电离方程式为N4H4(SO4)2 N4H44++2 SO42- N4H44++2 SO42- |
| C.N4H4(SO4)2不能与草木灰(K2CO3)等化肥混合施用 |
| D.N4H4(SO4)2中只含有共价键,不含离子键 |
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,
图中每个“ · ”代表一种元素,其中O点代表氢元素.下列说法中错误的是
A.离O点越远的元素原子半径一定越大
B.虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族
C.B元素是图中金属性最强的元素
D.B、C最高价氧化物的水化物可以相互反应
短周期元素X、Y、Z、W、Q在元素周期表的位置如下表所示,
其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是
| A.钠与Y可能形成Na2Y2化合物 |
| B.由Z与Y组成的物质在熔融时能导电 |
| C.单质的沸点:W < Q |
| D.X有多种同素异形体,而Y不存在同素异形体 |
如图表示物质通过一步反应的转化关系,下列说法正确的是
X(单质或化合物)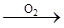 酸性氧化物
酸性氧化物 酸
酸
| A.X可能是Al |
| B.X可能是H2 |
| C.酸性氧化物可能是SiO2 |
| D.酸可能是H2SO4 |