同学们发现
溶液与
溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应? 在老师的帮助下,他们通过以下探究过程证明
溶液与
溶液发生了反应。
(1)实验装备
①查阅资料:
②用一定溶质的质量分数的
、
和
三种溶液进行如下实验,为设计实验方案提供参考。
| NaHCO3溶液 |
NaOH溶液 |
Na2CO3溶液 |
|
| 加入稀盐酸 |
现象Ⅰ |
无明显变化 |
产生气泡 |
| 加入澄清石灰水 |
溶液变浑浊 |
无明显变化 |
现象Ⅱ |
| 加入CaCl2溶液 |
无明显变化 |
溶液变浑浊 |
溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 |
澄清石灰水 变浑浊 |
澄清石灰水 无明显变化 |
澄清石灰水 无明显变化 |
表中的现象Ⅰ为,现象Ⅱ对应反应的化学方程式为。
(2)实验过程
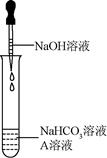
【实验1】证明反应生成了
同学们选用上表实验中的药品,设计了如图所示实验,先在
溶液中加入A溶液,无明显现象,再滴加
溶液,溶液变浑浊,则A溶液是。 有同学提出这个实验不足以证明有
生成,其理由是。为了证明有
生成,需要继续进行的操作是。
【实验2】证明反应后
不存在
同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是。
(3)实验反思
通过实验1和实验2说明,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是。
在学习了金属活动性顺序的知识后,小华想在实验室里通过实验验证一下Zn、Fe、Cu三种金属的活动性,设计了如下实验:
①取相同形状的铁片、锌片、铜片,分别用砂纸打磨至光亮,放入试管中。
②分别加入5毫升20%的稀硫酸,观察现象并记录到下面的表格中。
| 试管编号 |
1 |
2 |
3 |
| 反 应 物 |
Zn片+稀H2SO4 |
Fe片+稀H2SO4 |
Cu片+稀H2SO4 |
| 反应现象 |
气泡多、大、上升快 |
气泡细小,上升慢 |
没有气泡 |
(1)根据小华的实验设计可知,他是通过来判断金属活动性的。
(2)在实验过程中,细心的小华还发现了二个有趣现象①试管发烫,②反应的速度随时间而变化,他粗略的用图像画了下来(如下图)。反应速度为什么会这样变化呢?科学老师给了他一个启示:化学反应的速度跟反应温度、反应物的溶质质量分数有关。经过思考小华给出了一个合理的解释。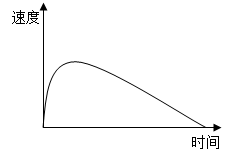
(3)对于验证三种金属的活动性,小明提出了一个更简单的方案:把锌片、铜片分别放入溶液,通过观察反应的现象就可以了。
为了解环境因素对维生素C含量的影响,从而更好地保存有关食物,某兴趣小组同学根据维生素C可使高锰酸钾(KMn04;)溶液褪色的原理,进行了如下表所示的实验。
| 编号 |
维生素C溶液的处理方法 |
使40毫升KMn04溶液褪色的平均滴数 |
| 1 |
放置于室内暗处0.5小时 |
15 |
| 2 |
强烈阳光直射5小时后,放置于室内暗处0.5小时 |
22 |
| 3 |
煮沸l0分钟后,放置于室内暗处0.5小时 |
21 |
(1)他们探究了___________对维生素C含量的影响;
(2)他们的探究对我们启示是:在贮存富含维生素C的食物时,应________________,以防止其中的维生素C过量流失,降低食物的营养价值;
(3)为了解维生素C的化学性质,他们用pH试纸测得该维生素C溶液的pH在1至2之间,说明维生素C具有________性。
某固体混合物中可能含有碳酸钙、硫酸铜、硫酸钠、碳酸钠、氯化钠中的一种或几种,现做以下实验:(1)将固体混合物溶于水,得到无色、透明的溶液。
(2)取少量溶液加入少量氢氧化钡溶液,有白色沉淀生成。过滤,得到白色沉淀。
(3)在白色沉淀中加入足量稀硝酸,沉淀部分溶解。
由以上实验可知,该固体混合物中一定含有;可能含有。
某小组同学进行了有关蜡烛成分测定的实验
| 实验步骤 |
现象 |
结论 |
|
 |
在蜡烛火焰上方罩一个冷而干燥的烧杯 |
烧杯内壁有小液滴 |
产物中有 |
| 将内壁涂有的烧杯罩在火焰上方 |
产物中有二氧化碳 |
由此可知:蜡烛的成分主要由元素组成,可能还含有 。
已知废旧普通干电池筒内主要有C、淀粉、MnO2、ZnCl2、NH4C1等物质,某化学兴趣小组同学欲通过实验从中回收MnO2,并研究MnO2在分解过氧化氢制氧气的反应中所起的作用。
【查阅资料】淀粉不溶于冷水,完全燃烧生成二氧化碳和水;碳、二氧化锰不溶于水。
ZnCl2、NH4Cl均易溶于水。
【进行实验】实验步骤如下图:
|
