目前人类已发现的非金属元素除稀有气体外,共有16种,对这16种非金属元素的相关判断:①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;③氢化物常温下都是气态;④氧化物常温下都可以与水反应生成酸。其中不正确的有( )
| A.只有①② | B.只有①③ | C.只有③④ | D.①②③④ |
实验室制Cl2的反应为4HCl(浓)+MnO2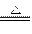 MnCl2+Cl2↑ +2H2O。下列说法错误的是()
MnCl2+Cl2↑ +2H2O。下列说法错误的是()
| A.还原剂是HCl,氧化剂是MnO2 |
| B.每生成1 mol Cl2,转移电子的物质的量为2 mol |
| C.每消耗1 mol MnO2,起还原剂作用的HCl消耗4 mol |
| D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
能源可划分为一级能源和二级能源。自然界中以现成形式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:2H2O(l)====2H2(g)+O2(g)。已知2 mol H2O(l)所具有的总能量低于2 mol H2(g)与1 mol O2(g)所具有的总能量。对于制取H2的反应,下列说法不正确的是()
| A.该反应是氧化还原反应 | B.该反应是分解反应 |
| C.该反应是放热反应 | D.该反应是吸热反应 |
某温度时,在2 L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图2-24所示。由图2-24中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均速率分别为()
图2-24
| A.X+Y====2Z;0.05 mol·L-1·min-1 |
| B.X+Y====2Z;0.1 mol·L-1·min-1 |
| C.X+2Y====Z;0.1 mol·L-1·min-1 |
| D.X+3Y====2Z;0.05 mol·L-1·min-1 |
实验表明,不能用块状大理石与稀硫酸制取CO2气体,而能用大理石粉末与稀硫酸制取CO2气体。由此得出的合理结论是()
| A.反应的物质之间是否发生反应,与反应的条件有关 |
| B.反应物之间接触面积越大,越有利于反应的进行 |
| C.块状大理石与大理石粉末的化学性质不同 |
| D.块状大理石与大理石粉末中各元素原子间电子的结合状况不同 |
实验室由MnO2和浓盐酸制取纯净的氯气时,气体通过两个洗气瓶,第二个洗气瓶应盛()
| A.稀盐酸 | B.浓硫酸 | C.水 | D.饱和食盐水 |