(10分) (1)已知某反应的各物质浓度数据如下:
_ 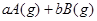

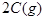
起始浓度(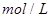 ): 1.5 1.0 0
): 1.5 1.0 0
2s末浓度(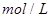 ): 0.9 0.8 0.4
): 0.9 0.8 0.4
则①a= ,b= 。
②2s内B的转化率= 。
(2)由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求
③有 mol电子从 通过电线到 (填“铁片”或“碳棒”)。
④此时溶液中H+的物质的量浓度为 (不考虑溶液体积变化)。
(3)将2.3g金属钠放入足量的m g重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是 (用含m的代数式表示。)
(6分)把2.0mol/L CuSO4溶液和2.0mol/L H2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。计算:(不必写过程,直接将答案填写在答题卡上)
(1)混合溶液中H+、Cu2+、SO42-的物质的量浓度;
(2)向溶液中加入铁粉,足够长的时间后,铁粉有剩余,过滤,此时滤液中的Fe2+的物质的量浓度;
(3)取100mL该滤液,向其中加入适量硝酸,再加入足量氢氧化钠溶液,有红褐色沉淀生成。过滤,加热沉淀物至质量不再变化,得到红棕色的残渣。写出残渣的化学式,并计算残渣的质量(不计操作带来的损失)。
把0.6 mol X气体和0.4 mol Y气体混合于2L容器中,发生反应:3X(g) + Y(g) ="==" nZ(g) +2W(g) , 5min末已生成0.2 mol W,若测知以Z浓度变化来表示的平均速率为0.01 mol.L-1.min-1. 计算:
(1)n的值为
(2)前5 min内用X表示的反应速率
(3)5 min末Y的浓度
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25mol·L-1。
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25mol·L-1。
求:(1)x的值是多少;
(2)B的平均反应速率;
(3)则反应开始前放入容器中A、B的物质的量。
一定质量的某金属 X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成6.02×1022个
X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成6.02×1022个  Xn+ ,这些阳离子共有1.3×6.02×1023个质子、1.4×6.02×1023个中子。
Xn+ ,这些阳离子共有1.3×6.02×1023个质子、1.4×6.02×1023个中子。
(1)求Z、n和A的值。(写过程)
(2)写出该金属与NaOH溶液反应的化学方程式。
(5分)向100 mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:
(1)加入B溶液110 mL时,溶液中的沉淀是,溶液中的溶质是。
(2)从90 mL至100mL之间加入10mL B溶液时发生的离子反应方程式是:
Ba2+ + SO42—→BaSO4↓,Al(OH)3 + OH— →AlO2— +2H2O
溶液B中Na2SO4与NaOH的物质的量浓度之比为;
(3)计算A溶液中AlCl3的物质的量浓度,写出计算过程: